
| 放电 |
| 充电 |
| ||
| ||
| 2×58.5g |
| 1mol |
| m(NaCl) |
| 3mol |


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 镁燃料电池具有高比能量、安全和成本低等特点,在军事和民用方面有良好的应用前景.镁燃料电池的氧化剂可以利用空气或者海水中的氧,还有过氧化氢和次氯酸盐等.
镁燃料电池具有高比能量、安全和成本低等特点,在军事和民用方面有良好的应用前景.镁燃料电池的氧化剂可以利用空气或者海水中的氧,还有过氧化氢和次氯酸盐等.查看答案和解析>>
科目:高中化学 来源: 题型:
 铝.
铝.查看答案和解析>>
科目:高中化学 来源: 题型:
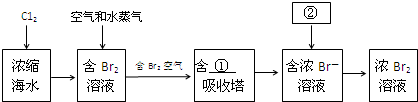
 如图是实验室制取 氯气的实验装置.
如图是实验室制取 氯气的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②⑨④ |
| C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
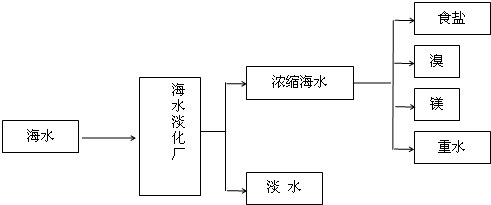
| A、海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” | |||
B、对于可逆反应N2(g)+3H2(g)
| |||
| C、硫酸工业中,从吸收塔上部导出的气体再次通入接触室进行二次氧化,进一步吸收后,二氧化硫的含量很少,可直接排放到空气中 | |||
| D、阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com