
| A、CH3COOH |
| B、CH3CH2OH |
| C、H2O |
| D、C6H5OH |


科目:高中化学 来源: 题型:
| A、充电时,电能转化为化学能 |
| B、充电时,电解质溶液的pH逐渐增大 |
| C、放电时,CH3OH参与反应的电极为负极,发生还原反应 |
| D、放电时,负极的电极反应为:CH3OH+8OH--6e-═CO32-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮气 | B、空气 | C、氯气 | D、氩气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:A<B<C |
| B、A的氢化物稳定性小于C的氢化物稳定性 |
| C、三种元素的最高价氧化物对应的水化物均可由化合反应得到 |
| D、高温下,B单质能置换出A单质,A单质能置换出C单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 |
| B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C、活化分子间所发生的碰撞为有效碰撞 |
| D、升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
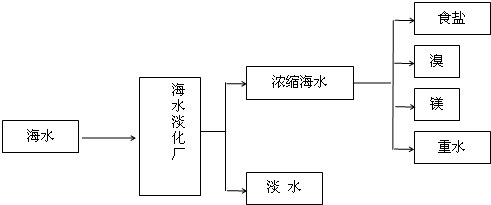
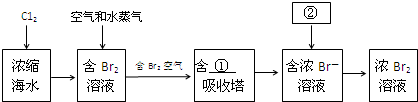
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com