
【题目】由C、H、O三种元素组成的链状有机化合物X,只含有羟基和羧基两种官能团,且羟基数目大于羧基数目。称取2.04 g纯净的X,与足量金属钠充分反应,生成672 mL氢气(标准状况)。请确定摩尔质量最小的X分子中羟基、羧基数目及该X的相对分子质量(要求写出简要推理过程)。
【答案】n(H2)=0.03 mol,设X中羟基和羧基的总数为m个(m≥3)则n(X)=(0.03×2)/m=0.06/m mol,M(X)=2.04m/0.06=34m g·mol1 m=4,M(X)=136 g·mol1,含有3个羟基和1个羧基,相对分子质量为136。
【解析】
利用X和足量金属钠反应计算羟基和羧基的总数目,其关系为2-OH~H2、H2~2-COOH,进而推理出摩尔质量最小的X。
n(H2)=![]() =0.03 mol,由于2-OH~H2、2-COOH ~H2,设X中羟基和羧基的总数为m个(m>2,且为整数),则n(X)=
=0.03 mol,由于2-OH~H2、2-COOH ~H2,设X中羟基和羧基的总数为m个(m>2,且为整数),则n(X)=![]() =
=![]() ,
,![]() 34m g/mol。当m=3,M(X)=102g/mol, 羟基数目大于羧基数目,说明含有2个羟基和1个羧基,说明X分子式有4个O,碳和氢的摩尔质量=102-16×4=38g/mol,分子式为C3H2O4, 2个羟基和1个羧基就占了3个H原子,可知这个分子式不合理,m=3不成立;当m=4,M(X)=136g/mol,说明含有3个羟基和1个羧基,同上分析可知分子式为C4H8O5,该分子式合理,例如可能的结构简式为
34m g/mol。当m=3,M(X)=102g/mol, 羟基数目大于羧基数目,说明含有2个羟基和1个羧基,说明X分子式有4个O,碳和氢的摩尔质量=102-16×4=38g/mol,分子式为C3H2O4, 2个羟基和1个羧基就占了3个H原子,可知这个分子式不合理,m=3不成立;当m=4,M(X)=136g/mol,说明含有3个羟基和1个羧基,同上分析可知分子式为C4H8O5,该分子式合理,例如可能的结构简式为![]() 。故答案是:含有3个羟基和1个羧基,相对分子质量为136。
。故答案是:含有3个羟基和1个羧基,相对分子质量为136。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿(主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2等杂质)为原料,制备金属钛和铁红的工艺流程如下:

已知:酸溶时,FeTiO3转化为Fe2+和TiO2+
(1)FeTiO3中Ti元素的化合价为_____价,铁红的用途为____________(任写一种)。
(2) “水解”中,发生反应的离子方程式为______________________________。
(3) “沉铁”中,生成的酸性气态产物的电子式为______________;该过程控制反应温度低于35℃,原因为_______________________________________。
(4)FeCO3转化为铁红时,发生的化学方程式为_______________________________。
(5)制得的FeCO3可加入足量的稀硫酸,则从溶液中获得绿矾的操作是_____________。
(6)电解生产钛时用TiO2 和石墨做电极,电解质为熔融的CaO,则阴极的反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1molO3的质量为________,O2的摩尔质量为________,2molO3和3molO2的质量之比为_____,分子数之比为_____,同温同压下的密度之比为_____.含氧原子数之比为_____.
(2)10.6gNa2CO3溶于水配成500mL 溶液,物质的量浓度为_________,其中Na+的物质的量浓度为________。
(3)标准状况下11.2LHCl气体的物质的量为________,所含氢原子与________g CH4中的氢原子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298.15 K时,可逆反应:Pb2+(aq)+Sn(s)![]() Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是
Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是
A. 向正反应方向进行 B. 向逆反应方向进行
C. 处于平衡状态 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物X由3种元素组成。某学习小组进行了如下实验:

请回答:
(1) 由现象1得出化合物X含有________元素(填元素符号)。
(2) 固体混合物Y的成分________(填化学式)。
(3) X的化学式________。X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到蓝色溶液,该反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应Ⅰ的化学方程式是______________________________________
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为____________________。
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。

①X代表的物理量是__________。
②判断L1、L2的大小关系:L1_______L2,并简述理由:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是

A. 对应简单离子半径X<W
B. 对应气态氢化物的稳定性Y<Z
C. 化合物XZW既含离子键也含共价键
D. Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g) ![]() Cl2(g) + CO(g) △H>0达到平衡时各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出)。
Cl2(g) + CO(g) △H>0达到平衡时各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出)。
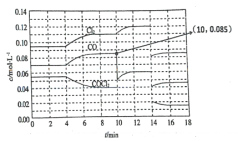
下列说法正确的是
A. 第4 min时改变的条件可能是扩大容器体积
B. 第2 min时的平衡常数K(2)大于第8 min时的平衡常数K(8)
C. 12 min时反应在温度T(8)下重新达到平衡,则此时c(COCl2) = 0.031 mol/L(结果保留两位有效数字)
D. 产物CO在2~3 min、5~6 min、12~13 min时的平均反应速率大小为:υ(5~6) > υ(2~3) > υ(12~13)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com