
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应Ⅰ的化学方程式是______________________________________
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为____________________。
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。

①X代表的物理量是__________。
②判断L1、L2的大小关系:L1_______L2,并简述理由:______________。
【答案】SO2+2H2O+I2=H2SO4+2HI 2SO3(g)2SO2(g)+O2(g) △H== + 196kJmol-1 温度 L1<L2 SO3(g)分解是体积增大的反应,当温度一定时,压强增大,SO3质量分数增大。
【解析】
(1)根据图中信息可知反应Ⅰ中反应物为SO2、H2O和I2,生成物为H2SO4和HI,根据氧化还原反应方程式的配平方法配平;
(2)根据反应Ⅱ和步骤ⅰ写出步骤ⅱ的热化学反应方程式为:2SO3(g)=2SO2(g)+O2(g)△H=+196KJmol-1;
(3)①该反应正反应为吸热反应,温度升高,平衡逆向移动,SO3的转化率减小,故X代表的物理量为温度;
②根据①可知L代表的物理量为压强。SO3(g)分解是体积增大的反应,当温度一定时,压强增大,SO3质量分数增大,故L2>L1。
(1)根据图中信息可知反应Ⅰ中反应物为SO2、H2O和I2,生成物为H2SO4和HI,故反应Ⅰ的化学方程式是SO2+2H2O+I2=H2SO4+2HI,故答案为:SO2+2H2O+I2=H2SO4+2HI。
(2)已知:①2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJmol-1②H2SO4(l)═SO3(g)+H2O(g)△H=+177kJmol-1,根据盖斯定律①-2×②可得:2SO3(g)=2SO2(g)+O2(g)△H=+196kJ/mol;故答案为:2SO3(g)=2SO2(g)+O2(g)△H=+196kJ/mol。
(3)①该反应正反应为吸热反应,温度升高,平衡逆向移动,SO3的转化率减小,故X代表的物理量为温度,故答案为:温度。
②根据①可知L代表的物理量为压强。SO3(g)分解是体积增大的反应,当温度一定时,压强增大,SO3质量分数增大,故L2>L1,故答案为:L2>L1;SO3(g)分解是体积增大的反应,当温度一定时,压强增大,SO3质量分数增大。


科目:高中化学 来源: 题型:
【题目】辉铜矿与铜蓝矿都是天然含硫铜矿,在地壳中二者常伴生存在。现取一份该伴生矿样品,经检测后确定仅含Cu2S、CuS和惰性杂质。为进一步确定其中Cu2S、CuS的含量,某同学进行了如下实验:
①取2.6g样品,加入200.0mL0.2000mol·L-1酸性KMnO4溶液,加热(硫元素全部转化为SO42-),滤去不溶杂质;
②收集滤液至250mL容量瓶中,定容;
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定,消耗20.00mL;
④加入适量NH4HF2溶液(掩蔽Fe3+和Mn2+,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应:2Cu2++4I-=2CuI+I2;
⑤加入2滴淀粉溶液,用0.1000mo1·L-1Na2S2O3溶液滴定,消耗30.00mL(已知:2S2O32-+I2=S4O62-+2I-)。
回答下列问题:
(1)写出Cu2S溶于酸性KMnO4溶液的离子方程式:___________;
(2)配制0.1000mol· L-1FeSO4溶液时要用煮沸过的稀硫酸,原因是___________,配制过程中所需玻璃仪器除了烧杯、玻璃棒、容量瓶外还有___________;
(3)③中取25.00mL待测溶液所用的仪器是___________;
(4)⑤中滴定至终点时的现象为___________;
(5)混合样品中Cu2S和CuS的含量分别为_________%、_________%(结果均保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证某单质与某浓酸在加热条件下反应生成气体甲和乙的成分,某同学设计了如下实验装置图,其中A装置用于检验气体甲:

(1)写出该非单质与浓酸反应的化学方程式:___________________________________。
(2)证明气体中含有乙的实验现象是___________________________________________。
(3)为除去甲,收集纯净干燥的气体乙,某同学欲选用下列装置:

则按气流从左到右,各接口连接顺序正确的是______________。
A.dcabh B.feabh C.feabg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中,反应A+2B![]() C分别在三种不同实验条件下进行,它们的起始状态均为c(A) = 0.100 mol·L-1 c(B) = 0.200 mol·L-1 、c(C) = 0 mol·L-1 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是
C分别在三种不同实验条件下进行,它们的起始状态均为c(A) = 0.100 mol·L-1 c(B) = 0.200 mol·L-1 、c(C) = 0 mol·L-1 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是

A. 反应的平衡常数:①<② B. 反应A+2B![]() C的△H >0
C的△H >0
C. 实验②平衡时B的转化率为60% D. 实验③平衡时c(C) = 0.04 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由C、H、O三种元素组成的链状有机化合物X,只含有羟基和羧基两种官能团,且羟基数目大于羧基数目。称取2.04 g纯净的X,与足量金属钠充分反应,生成672 mL氢气(标准状况)。请确定摩尔质量最小的X分子中羟基、羧基数目及该X的相对分子质量(要求写出简要推理过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(s)![]() x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. 反应达到平衡状态时A的转化率为60%
B. x=4
C. 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D. 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
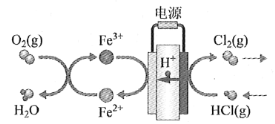
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是

A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com