
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是

A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
【答案】C
【解析】
邻苯二甲酸氢钾为二元弱酸酸式盐,溶液呈酸性,向邻苯二甲酸氢钾溶液中加入氢氧化钠溶液,两者反应生成邻苯二甲酸钾和邻苯二甲酸钠,溶液中离子浓度增大,导电性增强,邻苯二甲酸钾和邻苯二甲酸钠为强碱弱酸盐,邻苯二甲酸根在溶液中水解使溶液呈碱性。
A项、向邻苯二甲酸氢钾溶液中加入氢氧化钠溶液,两者反应生成邻苯二甲酸钾和邻苯二甲酸钠,溶液中Na+和A2—的浓度增大。由图像可知,溶液导电性增强,说明导电能力与离子浓度和种类有关,故A正确;
B项、a点和b点K+的物质的量相同,K+的物质的量浓度变化不明显,HA—转化为A2—,b点导电性强于a点,说明Na+和A2—的导电能力强于HA—,故B正确;
C项、b点邻苯二甲酸氢钾溶液与氢氧化钠溶液恰好完全反应生成邻苯二甲酸钾和邻苯二甲酸钠,邻苯二甲酸钾为强碱弱酸盐,A2—在溶液中水解使溶液呈碱性,溶液pH>7,故C错误;
D项、b点邻苯二甲酸氢钾溶液与氢氧化钠溶液恰好完全反应生成等物质的量的邻苯二甲酸钾和邻苯二甲酸钠,溶液中c(Na+)和c(K+)相等,c点是继续加入氢氧化钠溶液后,得到邻苯二甲酸钾、邻苯二甲酸钠、氢氧化钠的混合溶液,则溶液中c(Na+)>c(K+),由图可知,a点到b点加入氢氧化钠溶液的体积大于b点到c点加入氢氧化钠溶液的体积,则溶液中c(K+)>c(OH—),溶液中三者大小顺序为c(Na+)>c(K+)>c(OH—),故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色变深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略体积变化。
A. 实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3
B. 实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C. 实验③中,存在可逆反应: Fe3+ + 4Cl-+ 2H2O ![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D. 实验④,可证明升高温度,Fe3+水解平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应Ⅰ的化学方程式是______________________________________
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为____________________。
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。

①X代表的物理量是__________。
②判断L1、L2的大小关系:L1_______L2,并简述理由:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是

A. 对应简单离子半径X<W
B. 对应气态氢化物的稳定性Y<Z
C. 化合物XZW既含离子键也含共价键
D. Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
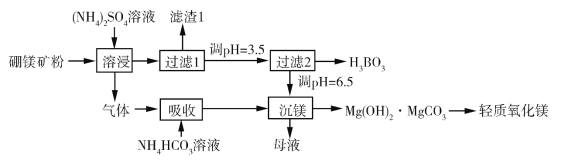
回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,重水(D2O)的离子积常数为1.6×10-15,用定义pH一样来规定pD,则pD=-lg[c(D+))。该温度下,下列叙述正确的是
A. 纯净的重水(D2O)中,pD=7
B. 纯净的重水中,c(D+)·c(OD-) > 1×10-14
C. 将0.01 mol DC1溶于水形成1 L的重水溶液,其pD=2
D. NH4Cl溶于D2O中生成的一水合氨和水合氢离子的化学式为NH3·D2O和HD2O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com