
����Ŀ���������ҹ���ѧ�ҷ�����һϵ�������ش����ϵ�������ϣ�����һ��ΪFeSmAsFO��ɵĻ�����ش��������⣺
��1��Ԫ��As��Nͬ�塣Ԥ��As���⻯����ӵ�����ṹΪ_______����е��NH3��_______�������������������������ж�������_________________________��
��2��Fe��Ϊ������ʱ����ʧȥ______������ӣ�Sm�ļ۲�����Ų�ʽΪ4f66s2��Sm3+�ļ۲�����Ų�ʽΪ______________________��
��3���Ƚ����Ӱ뾶��F__________O2����������������������С��������
��4��һ���ķ��ṹ�ij���������ľ����ṹ��ͼ1��ʾ��������Sm��Asԭ�ӵ�ͶӰλ����ͼ2��ʾ��

ͼ��F��O2��ͬռ�ݾ��������µ���λ�ã������ߵı���������x��1x��������û�����Ļ�ѧʽ��ʾΪ____________��ͨ���ⶨ�ܶ����;������������Լ�������ʵ�xֵ��������ǹ�ϵ����ʽ����=________g��cm3��
�Ծ�������Ϊ��λ���Ƚ���������ϵ���Ա�ʾ�����и�ԭ�ӵ�λ�ã�����ԭ�ӷ������꣬����ͼ1��ԭ��1������Ϊ(![]() )����ԭ��2��3������ֱ�Ϊ__________��__________��
)����ԭ��2��3������ֱ�Ϊ__________��__________��
���𰸡������� �� NH3���Ӽ������� 4s 4f5 С�� SmFeAsO1xFx ![]()
![]()
![]()
��������
��1��As��Nͬ�壬��AsH3���ӵ�����ṹ������NH3��Ϊ�����Σ�����NH3���Ӽ�������ʹ�е����ߣ���AsH3�ķе��NH3�ͣ�
�ʴ�Ϊ�������Σ��ͣ�NH3���Ӽ���������
��2��FeΪ26��Ԫ�أ�Feԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d64s2��Feԭ��ʧȥ1������ʹ4s���Ϊ�����״̬�������ϵͣ�������ʧȥ4s������ӣ�Sm�ļ۵����Ų�ʽΪ4f66s2��ʧȥ3�����ӱ��Sm3+��Ϊ�ȶ�״̬����Ӧ��ʧȥ�����ϸߵ�4s���ӣ�����Sm3+�ļ۵����Ų�ʽΪΪ4f5��
�ʴ�Ϊ��4s��4f5��
��3��F-��O2-�ĺ�������Ų���ͬ���˵����Խ����뾶ԽС���ʰ뾶��F-<O2-��
�ʴ�Ϊ��<��
��4����ͼ1��֪��ÿ�������к�Smԭ�ӣ�4![]() =2����Feԭ�ӣ�4
=2����Feԭ�ӣ�4![]() +1=2����Asԭ�ӣ�4
+1=2����Asԭ�ӣ�4![]() =2����Oԭ�ӣ���8
=2����Oԭ�ӣ���8![]() +2
+2![]() ����1-x��=2��1-x������Fԭ�ӣ���8
����1-x��=2��1-x������Fԭ�ӣ���8![]() +2
+2![]() ��x=2x�����Ըû�����Ļ�ѧʽΪSmFeAsO1-xFx��
��x=2x�����Ըû�����Ļ�ѧʽΪSmFeAsO1-xFx��
���ݸû�����Ļ�ѧʽΪSmFeAsO1-xFx��һ������������Ϊ ��һ�����������Ϊa2c
��һ�����������Ϊa2c![]() 10-30cm3�����ܶ�
10-30cm3�����ܶ�![]() =
= g/cm3��
g/cm3��
�ʴ�Ϊ��SmFeAsO1-xFx�� ��
��
����ԭ��1�����꣨![]() ��
��![]() ��
��![]() ������֪ԭ��2��3������ֱ�Ϊ��
������֪ԭ��2��3������ֱ�Ϊ��![]() ��
��![]() ��0������0��0��
��0������0��0��![]() ����
����
�ʴ�Ϊ����![]() ��
��![]() ��0������0��0��
��0������0��0��![]() ����
����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ��������ͼ��ʾ��

(1)��Ӧ��Ļ�ѧ����ʽ��______________________________________
(2)��֪��Ӧ��2H2SO4(l)��2SO2(g)��O2(g)��2H2O(g) ��H����550 kJ��mol��1
����������Ӧ��ɣ�i��H2SO4(l)��SO3(g)��H2O(g) ��H����177 kJ��mol��1
ii��SO3(g)�ֽ⡣
��SO3(g)�ֽ���Ȼ�ѧ����ʽΪ____________________��
(3)L��L1��L2����X�ɷֱ����ѹǿ���¶�����֮һ����ͼ��ʾLһ��ʱ��ii��SO3(g)������������X�ı仯��ϵ��

��X��������������__________��
���ж�L1��L2�Ĵ�С��ϵ��L1_______L2�����������ɣ�______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֶ�����Ԫ��, ���ǵ�ԭ��������A��D��������, ��֪A��Bԭ������ͬ�ĵ��Ӳ���, ��A��L���������K�������������, C�ڿ�����ȼ��ʱ���ֻ�ɫ����, C�ĵ����ڼ�������B�ĵ��ʳ�ַ�Ӧ, ���Եõ���D������ɫ��ͬ�ĵ���ɫ��̬������, �Ը������������ش�:
��1��Ԫ������: A ______ B _____ C _____ D ______
��2��DԪ��λ�����ڱ���___________����____________��
��3��д��AB2��C2B2��Ӧ�Ļ�ѧ����ʽ��________________________________________��
��4������ʽ��ʾ������ C2D ���γɹ��̣�________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���ˮ(D2O)�����ӻ�����Ϊ1.6��10-15���ö���pHһ�����涨pD����pD=-lg[c(D+))�����¶��£�����������ȷ����
A. ��������ˮ(D2O)�У�pD=7
B. ��������ˮ�У�c(D+)��c(OD-) > 1��10-14
C. ��0.01 mol DC1����ˮ�γ�1 L����ˮ��Һ����pD=2
D. NH4Cl����D2O�����ɵ�һˮ�ϰ���ˮ�������ӵĻ�ѧʽΪNH3��D2O��HD2O+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦCOCl2(g) ![]() Cl2(g) + CO(g) ��H>0�ﵽƽ��ʱ�����ʵ�Ũ���ڲ�ͬ�����µı仯״����ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯����δʾ��)��
Cl2(g) + CO(g) ��H>0�ﵽƽ��ʱ�����ʵ�Ũ���ڲ�ͬ�����µı仯״����ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯����δʾ��)��
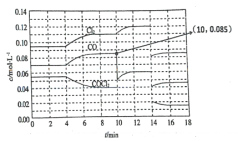
����˵����ȷ����
A. ��4 minʱ�ı�����������������������
B. ��2 minʱ��ƽ�ⳣ��K(2)���ڵ�8 minʱ��ƽ�ⳣ��K(8)
C. 12 minʱ��Ӧ���¶�T(8)�����´ﵽƽ�⣬���ʱc(COCl2) = 0.031 mol/L(���������λ��Ч����)
D. ����CO��2~3 min��5~6 min��12~13 minʱ��ƽ����Ӧ���ʴ�СΪ����(5~6) > ��(2~3) > ��(12~13)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������֬����������õĻ�е���ܡ���Ե�����Լ�����ֲ��ϵ�ճ�����ܣ��ѹ㷺Ӧ����Ϳ�Ϻͽ����������������Ʊ�һ�����ͻ�����֬G�ĺϳ�·�ߣ�


��֪������Ϣ��

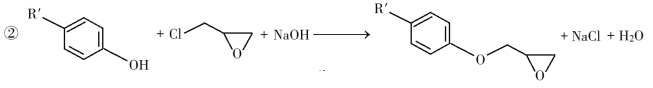
 �ش��������⣺
�ش��������⣺
��1��A��һ��ϩ������ѧ����Ϊ__________��C�й����ŵ�����Ϊ__________��__________��
��2����B����C�ķ�Ӧ����Ϊ__________��
��3����C����D�ķ�Ӧ����ʽΪ__________��
��4��E�Ľṹ��ʽΪ__________��
��5��E�Ķ��ȴ����ж���ͬ���칹�壬��д��������ͬʱ�������������ķ��㻯����Ľṹ��ʽ__________��__________��
���ܷ���������Ӧ���ں˴Ź�������������壬�ҷ������Ϊ3��2��1��
��6�����軯����D��F��NaOHǡ����ȫ��Ӧ����1 mol��һ�ۺ϶ȵ�G�������ɵ�NaCl��H2O��������Ϊ765g����G��nֵ������Ӧ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ��������һ�����͵ĸ߱�����п-����Һ����أ��乤��ԭ��ʾ��ͼ���¡�ͼ����Һ���ɴ���������Һ����ߵ�ص�������������������ȷ����

A. �ŵ�ʱ��a�缫��ӦΪ
B. �ŵ�ʱ����Һ�����ӵ���Ŀ����
C. ���ʱ��b�缫ÿ����![]() ����Һ����
����Һ����![]() ������
������
D. ���ʱ��a�缫�����Դ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����0.5 mol��L1CH3COONa��Һ��0.5 mol��L1 CuSO4��Һ�Լ�H2O��pH���¶ȱ仯��������ͼ��ʾ������˵����ȷ����

A. ���¶����ߣ���ˮ��c(H+)>c(OH)
B. ���¶����ߣ�CH3COONa��Һ��c(OH)��С
C. ���¶����ߣ�CuSO4��Һ��pH�仯��Kw�ı���ˮ��ƽ���ƶ���ͬ���õĽ��
D. ���¶����ߣ�CH3COONa��Һ��CuSO4��Һ��pH�����ͣ�����ΪCH3COO��Cu2+ˮ��ƽ���ƶ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2����Դ����������Ч����CO2�ŷţ��������̼��Դ��
��1��CaO���ڽϸ��¶��²���CO2���ڸ����¶��½�������CO2�ͷ����á�CaC2O4��H2O�ȷֽ���Ʊ�CaO��CaC2O4��H2O�������¹����й���������仯����ͼ��

��д��400~600 �淶Χ�ڷֽⷴӦ�Ļ�ѧ����ʽ��________��
����CaCO3�ȷֽ��Ʊ���CaO��ȣ�CaC2O4��H2O�ȷֽ��Ʊ���CaO���и��õ�CO2�������ܣ���ԭ����________��
��2����ⷨת��CO2��ʵ��CO2��Դ�����á����CO2��HCOOH��ԭ��ʾ��ͼ���¡�

��д������CO2��ԭΪHCOO�ĵ缫��Ӧʽ��________��
�ڵ��һ��ʱ�����������KHCO3��ҺŨ�Ƚ��ͣ���ԭ����________��
��3��CO2������ϳɶ�������һ��CO2ת�����������������Ҫ�������з�Ӧ��
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H =41.2 kJ��mol1
CO(g)+H2O(g) ��H =41.2 kJ��mol1
��Ӧ��2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ��H =��122.5 kJ��mol1
CH3OCH3(g)+3H2O(g) ��H =��122.5 kJ��mol1
�ں�ѹ��CO2��H2����ʼ��һ���������£�CO2ƽ��ת���ʺ�ƽ��ʱCH3OCH3��ѡ�������¶ȵı仯��ͼ�����У�

CH3OCH3��ѡ����=![]() ��100��
��100��
���¶ȸ���300 �棬CO2ƽ��ת�������¶����߶�������ԭ����________��
��220 ��ʱ���ڴ���������CO2��H2��Ӧһ��ʱ����CH3OCH3��ѡ����Ϊ48%��ͼ��A�㣩�����ı䷴Ӧʱ����¶ȣ�һ�������CH3OCH3ѡ���ԵĴ�ʩ��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com