
����Ŀ��2007��ȫ����ʯ�ͼ۸�Ӹ߲��£�����Ҫԭ����������������ķ�չ���˿����࣬����Դ���������������ӣ�ȫ��ʯ�ʹ����½���Ѱ����Ʊ����ų����ڽ���������Դ�Ѿ���Ϊ��������ѧ�����������о�����Ȼ���ʹ���ϳ��������͵ķ�����
��֪����1������ȩ��ֱ��������̼ԭ���ϵ����Ϊ��һHԭ�ӣ���ϡ����Һ�Ĵ������£�һ��ȩ�����ϵ���һHԭ�����ӵ���һ��ȩ���ӵ���ԭ���ϣ����ಿ�����ӵ��ʻ�̼ԭ���������ǻ�ȩ���磺
��1��R-CH2-CHO+R1-CH2-CHO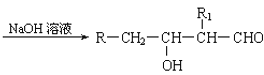
��2��2R-CH2-Cl+2Na![]() R-CH2-CH2-R+2NaCl
R-CH2-CH2-R+2NaCl
��3��CH3-CH=CH2+H-Cl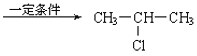
�ϳ�·�����£�
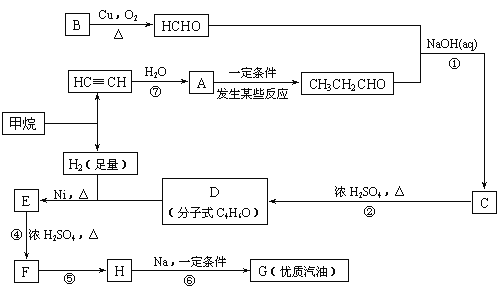
��1��д��D�Ľṹ��ʽ___��
��2���ڷ�Ӧ�ڡ����У����ڼӳɷ�Ӧ����___��������ȥ��Ӧ����___��
��3��д����Ӧ����ʽ��E��F��___��
��4��HҲ����NaOHˮ��Һ��Ӧ���䷴Ӧ����ʽΪ___��
���𰸡�CH2=C(CH3)CHO �ۢݢ� �ڢ� (CH3)2CHCH2OH ![]() (CH3)2C=CH2 +H2O
(CH3)2C=CH2 +H2O 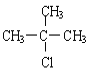 +NaOH
+NaOH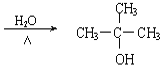 +NaCl
+NaCl
��������
�ɺϳ�·�߿�֪��BΪCH3OH����Ӧ��ΪCH��CH��ˮ�ļӳɷ�Ӧ����AΪCH2=CHOH��CH3CHO�������Ϣ��֪��HCHO��CH3CH2CHO������Ӧ��Ϊ�ӳɷ�Ӧ����CΪCH2OHCH(CH3)CHO����Ӧ��Ϊ��ȥ��Ӧ����DΪCH2=C(CH3)CHO��D�������ӳ�����E����EΪ(CH3)2CHCH2OH����Ӧ��Ϊ��ȥ��Ӧ������FΪ(CH3)2C=CH2����Ӧ��ΪF��HCl�ļӳɷ�Ӧ������HΪ(CH3)3CCl����Ӧ��Ϊȡ����Ӧ����GΪ(CH3)3CC(CH3)3��Ȼ�����л���Ľṹ�����������
(1)������������֪��DΪCH2=C(CH3)CHO���ʴ�Ϊ��CH2=C(CH3)CHO��
(2)������������֪����Ӧ�ڡ����У�D��E�ķ�Ӧ��Ϊ�ӳɣ�F��H�ķ�Ӧ��Ϊ�ӳɣ���Ӧ��ΪCH��CH��ˮ�ļӳɷ�Ӧ��C��D�ķ�Ӧ��Ϊ��ȥ��Ӧ��E��F�ķ�Ӧ��Ϊ��ȥ��Ӧ���ʴ�Ϊ���ۢݢߣ��ڢܣ�
(3)EΪ(CH3)2CHCH2OH��FΪ��E����FΪ�ǻ�����ȥ��Ӧ������ʽΪ��(CH3)2CHCH2OH ![]() (CH3)2C=CH2 +H2O��
(CH3)2C=CH2 +H2O��
(4)HΪ(CH3)3CCl������������ˮ��Һ�з���ȡ����Ӧ������ʽΪ��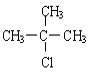 +NaOH
+NaOH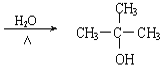 +NaCl��
+NaCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����豶���������к��в��ӣ���������Ŀǰ�в����˹��ϳɵĴ���Ȼ����ܡ���Ч�ܵĿ������������ɻ�������������ûʳ�Ӷ�����(EGC)�Ľṹ��ͼ��ʾ������EGC��������������ȷ���� ( )
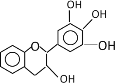
A.���������е�ԭ�ӹ���
B.1molEGC��4molNaOHǡ����ȫ��Ӧ
C.����������Ӧ��ȡ����Ӧ�����ܷ����ӳɷ�Ӧ
D.��FeCl3��Һ������ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����֪�л���A����Է���������28�����IJ����Ǻ���һ������ʯ�ͻ���ˮƽ�ı�־��B��D�����ճ�����ʳƷ�г������л��E�Ǿ���Ũ����ζ����������ˮ����״Һ�壬F��һ�ָ߾����������������ʳ�ﱣ��Ĥ��
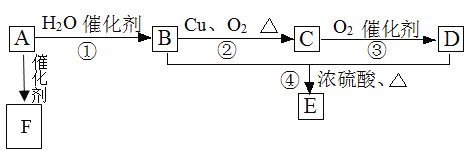
��1����д��A�Ľṹ��ʽ___��C�Ľṹʽ___��
��2����д����B�й����ŵĵ���ʽ___��D�й����ŵ�����___��
��3����д�����з�Ӧ�����ͣ���___����___����___��
��4����д����������ת���Ļ�ѧ����ʽ��
A��F��___��
B��C��___��
B+D��E��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��![]() CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�ӦΪ___��Ӧ��ѡ�����ȡ����ȣ���
��2��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2��=c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ___�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͤ���о�С���������ҽ����,����As2O3(�׳���˪)��Ѫ�������Ե��������á���(N)����(P)����(As)�ȶ���VA���Ԫ��,����Ԫ�صĻ��������о�����������������Ҫ��;���ش���������:
��1��NH3�ķе��PH3_____(���"�͡�)��ԭ����_____________��
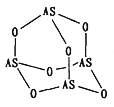
��2��Na3AsO4 �к��еĻ�ѧ�����Ͱ���_______��AsO43-�Ŀռ乹��Ϊ_______��As4O6�ķ��ӽṹ��ͼ��ʾ�����ڸû�������As���ӻ���ʽ��_________��
��3����Ȼ�̵���������һϵ�л�ѧ�仯��N2��NO��NO2��HNO3��NO3-���������衰���귢ׯ�ڡ���ԭ����
��NO3-��Nԭ�Ӳ�ȡ_____�ӻ���ʽ����ռ乹��Ϊ________��д������һ�ֵȵ�����Ļ�ѧʽ________.
����֪���ԣ� HNO3>HNO2��������ؼ����������_________.
A������������ԭ������Խ�࣬����Խǿ
B��ͬ��Ԫ�ػ��ϼ�Խ�ߣ���Ӧ�����������Խǿ
C��HNO3�е�Ԫ�ص������Ը��ߣ���ˮ��Һ�и������H+������ǿ��HNO2
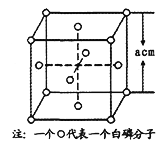
��4������(P4)�ľ������ڷ��Ӿ��壬�侧���ṹ��ͼ(СԲȦ��ʾ������)����֪�����ı߳�Ϊacm�������ӵ�����ΪNA mol-1����þ����к��е�Pԭ�ӵĸ���Ϊ______���þ�����ܶ�Ϊ______g��cm-3(�ú�NA��a��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.�ⶨ��ѧ��Ӧ����
ijͬѧ������ͼװ�òⶨ��ѧ��Ӧ���ʡ�
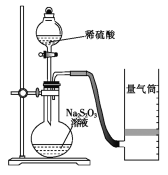
(��֪��S2O32-+2H+=H2O+S��+SO2��)
��1��Ϊ��֤ʵ��ȷ�ԡ��ɿ��ԣ����ø�װ�ý���ʵ��ǰӦ�Ƚ��еIJ�����__������ͼ��ʾ��ʵ����Ʒ�������⣬����Ҫ��һ��ʵ��������__��
��2������2minʱ�ռ���224mL(������ɱ�״��)���壬�ɼ������2min��H+�ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ����___��
��.Ϊ̽�ֻ�ѧ��Ӧ���ʵ�Ӱ������
ijС������H2C2O4��Һ������KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족����֪��5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
ʵ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������ѡ�Լ���������0.20mol/LH2C2O4��Һ��0.010mol/L����KMnO4��Һ������ˮ����ƿ������ˮԡ�ۣ���Ͳ���������С����������µķ�����
������ | ˮ | H2C2O4��Һ | ����KMnO4��Һ | �¶�/�� | ||
���/mL | Ũ��/molL-1 | ���/mL | Ũ��/molL-1 | ���/mL | ||
�� | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
�� | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
�� | 1.0 | 0.010 | 4.0 | 25 | ||
��1����֪��Ӧ��H2C2O4ת��ΪCO2�ݳ���KMnO4ת��ΪMnSO4��Ϊ�˹۲쵽��ɫ��ȥ��H2C2O4��KMnO4��ʼ�����ʵ�����Ҫ����Ĺ�ϵΪ��n(H2C2O4)��n(KMnO4)��__��
��2��ʵ��۲��KMnO4��Һ����ɫʱ��Ϊ40s�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v��KMnO4��=__mol��L-1��min-1��
��3������ɱ����ڶ����հ�__��__��
��4����֪50��ʱc(MnO4-)����Ӧʱ��t�ı仯������ͼ�����з�Ӧ�������Ľ���__��ԭ����___��
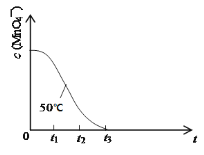
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ԭ�Ӻ�����Ӽ����˶�״̬��������ȷ���ǣ� ��
�ٿ��Բⶨijһʱ�̵���������λ��
�ڵ���������С�Ҵ������
�����ԭ�Ӻ˵Ĵ�С�������˶��Ŀռ䷶Χ�ܴ�
�ܸ����˶�
���й̶����˶����
���ӵ�����ԼΪ������������![]()
A.�٢ڢ�B.�ڢۢܢ�
C.�ۢܢݢ�D.�ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д��������ĿҪ��Ļ�ѧ���Ż�ָ�����ֱ�ʾ������
��1��5�������ӣ�___��
��2��2�������ӣ�___��
��3��Ca2+�����֡�2�������壺___��
��4��������ԭ�ӽṹʾ��ͼ��___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com