
分析 假设浓硫酸体积为1L、水体积为5L,浓硫酸的物质的量=$\frac{1000mL×ρg/mL×98%}{98g/mol}$=10ρmol,溶液体积=$\frac{1000mL×ρg/mL+5000mL×1g/mL}{dg/mL}$=$\frac{1000ρ+5000}{d}mL$=$\frac{ρ+5}{d}$L,
混合溶液物质的量浓度c=$\frac{n}{V}$.
解答 解:假设浓硫酸体积为1L、水体积为5L,浓硫酸的物质的量=$\frac{1000mL×ρg/mL×98%}{98g/mol}$=10ρmol,溶液体积=$\frac{1000mL×ρg/mL+5000mL×1g/mL}{dg/mL}$=$\frac{1000ρ+5000}{d}mL$=$\frac{ρ+5}{d}$L,
混合溶液物质的量浓度c=$\frac{n}{V}$=$\frac{10ρmol}{\frac{ρ+5}{d}L}$=$\frac{10ρd}{p+5}$mol/L,
故答案为:$\frac{10ρd}{p+5}$mol/L.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生计算能力,明确“溶液体积不等于浓硫酸和水体积之和“是解本题关键,注意体积单位换算,为易错题.


科目:高中化学 来源: 题型:选择题
| A. | 同质量H2与Cl2,H2的分子数比Cl2多 | |
| B. | 摩尔是用来衡量微观粒子多少的物理量 | |
| C. | 0.1molH2SO4含有氢原子数的精确值为1.204×1023 | |
| D. | 0.5mol氢的质量是0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA | |
| B. | 足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA | |
| C. | 密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA | |
| D. | 常温常压下,92 g的NO2和N2O4混合气体含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、NO3- | B. | Al3+、Na+、NO3-、Cl- | ||
| C. | K+、Na+、Cl-、AlO2- | D. | K+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=0.1mol/(L•s) | D. | υ(D)=0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ①④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为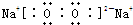 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:
一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com