
| A. | ①② | B. | ②③④ | C. | ①④ | D. | ①②③④⑤ |
分析 ①二氧化锰在加热条件下可以氧化浓盐酸生成氯气;
②KMnO4具有强的氧化性,能够氧化浓盐酸得氯气;
③NaClO和氯化氢发生归中反应生成氯气;
④K2Cr2O7具有强的氧化性,能够氧化浓盐酸得氯气;
⑤KClO3具有强的氧化性,能够氧化浓盐酸得氯气.
解答 解:①二氧化锰在加热条件下可以氧化浓盐酸生成氯气,可以用①来制备氯气;
②KMnO4具有强的氧化性,能够氧化浓盐酸得氯气,可以用②来制备氯气;
③NaClO和氯化氢发生归中反应生成氯气,可以用③来制备氯气;
④K2Cr2O7具有强的氧化性,能够氧化浓盐酸得氯气,可以用④来制备氯气;
⑤KClO3具有强的氧化性,能够氧化浓盐酸得氯气,可以用⑤来制备氯气;
故选:D.
点评 本题以氯气的制备为载体考查了氯气的性质,题目综合性较强,侧重考查依据所学知识分析问题、解决问题的能力,难度中等.


科目:高中化学 来源: 题型:解答题
 ,其中氮的化合价为-2.
,其中氮的化合价为-2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 | |
| C. | 食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿 | |
| D. | 味精能增加食品的鲜味,促进食欲,炒菜时应该多放一点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据 | |
| B. | 物质发生化学变化不一定伴随着能量变化 | |
| C. | 发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 | |
| D. | 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
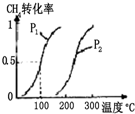 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| Ⅰ | 150 | 1/3 | 0.1 |
| Ⅱ | 5 | ||
| Ⅲ | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
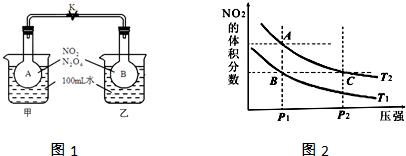
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com