(2012?门头沟区一模)“富煤、贫油、少气”是我国能源发展面临的现状.随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义.下图是煤化工产业链之一.

“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H
2.CO和H
2可作为能源和化工原料,应用十分广泛.
(1)已知:
C(s)+O
2(g)=CO
2(g)△H
1=-393.5kJ/mol①
C(s)+H
2O(g)=CO(g)+H
2(g)△H
2=+131.3kJ/mol②
则反应CO(g)+H
2(g)+O
2(g)=H
2O(g)+CO
2(g),△H=
-524.8
-524.8
kJ/mol.在标准状况下,33.6L的煤炭合成气与氧气完全反应生成CO
2和H
2O,反应过程中转移
3
3
mol e
-.
(2)在一恒容的密闭容器中,由CO和H
2合成甲醇:CO(g)+2H
2(g)?CH
3OH(g)
①下列情形能说明上述反应已达到平衡状态的是
ad
ad
a.体系压强保持不变
b.密闭容器中CO、H
2、CH
3OH(g)3种气体共存
c.CH
3OH与H
2物质的量之比为1:2
d.每消耗1mol CO的同时生成2molH
2②CO的平衡转化率(α)与温度、压强的关系如下图所示.

A、B两点的平衡常数
一样
一样
(填“前者”、“后者”或“一样”)大;达到A、C两点的平衡状态所需的时间t
A大于
大于
t
C(填“大于”、“小于”或“等于”).在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是
降温、加压、将甲醇从混合体系中分离出来
降温、加压、将甲醇从混合体系中分离出来
(答出两点即可).
(3)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H
2)作负极燃气,空气与CO
2的混合气体为正极燃气,用一定比例的Li
2CO
3和Na
2CO
3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的.负极的电极反应式为:CO+H
2-4e
-+2CO
32-=3CO
2+H
2O;则该电池的正极反应式为
O2+4e-+2CO2=2CO32-
O2+4e-+2CO2=2CO32-
.





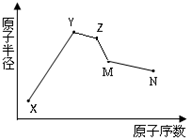 (2012?门头沟区一模)X、Y、Z、M、N五种常见的短周期元素原子半径随原子序数变化如图.已知X的一种原子的质量数为18,中子数为10;Y和Ne原子的核外电子数相差1;M的单质是一种常见的半导体材料;N的原子半径在同周期主族元素中最小;Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应.下列说法错误的是( )
(2012?门头沟区一模)X、Y、Z、M、N五种常见的短周期元素原子半径随原子序数变化如图.已知X的一种原子的质量数为18,中子数为10;Y和Ne原子的核外电子数相差1;M的单质是一种常见的半导体材料;N的原子半径在同周期主族元素中最小;Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应.下列说法错误的是( )