
(15分)通过测量一定质量的Fe、Al合金与M的溶液反应生成H2在标准状况下的体积,可以计算出合金中Fe、Al的旗量分数,若用下图装置来制取H2,请完成下列操作步骤直至产生H2。
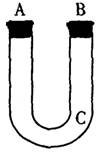
(1)C处塞入玻璃丝绒团;
(2) A 处 ___________________________
(3) B处_____________________________
(4) ____________________________________
(5) ____________________________________;
(6) 在分液櫬斗中加入M的溶液。
(7) ______________________________________________________
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:阅读理解
 某化学小组探究液体有机物样品A(C3H8O2)的结构,进行如下实验.
某化学小组探究液体有机物样品A(C3H8O2)的结构,进行如下实验.| 实验编号 | 有机样品的体积 | 有机样品的质量 | 生成气体的体积(标准状况下) | I | 3.65mL | 3.8g | 1120mL | II | 7.30mL | 7.6g | 2240mL | III | 14.60mL | 15.2g | 4000mL |
查看答案和解析>>
科目:高中化学 来源:2010年哈三中等四校高三第四次高考模拟考试(理综)化学部分 题型:实验题
(15分)已知CaSO4受热分解,由于受热温度不同,气体成分也不同。气体成分可能为SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组准备通过系列实验探究CaSO4分解生成的气体,进而确定CaSO4分解的化学方程式。
【提出猜想】
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有 二种;(填分子式)
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种。
【设计实验】
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式。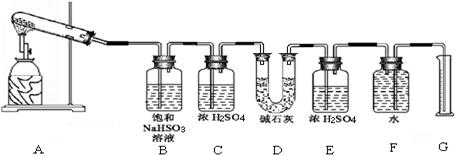
【实验过程】
根据上述实验方案进行试验。已知实验结束时,CaSO4完全分解。
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想 正确。(填Ⅰ或Ⅱ或Ⅲ)
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由: 。
(3)该实验设计中,容易给测 定带来较大误差的因素有 。
定带来较大误差的因素有 。
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
| 实验小组 | 称取CaSO4 的质量(g) | 装置D增加 的质量(g) | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
| 一 | 4.08 | 2. 56 56 | 224 |
| 二 | 5.44 | 2.56 | 448 |
查看答案和解析>>
科目:高中化学 来源:2010年江苏省南京市高三上学期期中考试化学试题 题型:实验题
(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
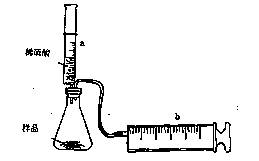 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
|
|
50mL稀硫酸 |
50mL稀硫酸 |
50mL稀硫酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:
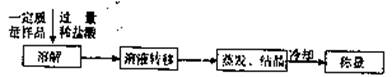
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08潮阳一中模拟)(15分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列实验没有错误的是 。

(2)下图为常见仪器的部分结构(有的仪器被放大)


A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
(3)化学研究小组,通过网上查找资料发现,Cl2的制取有下列不同方案:
![]() 方案:加热条件下二氧化锰与浓盐酸反应制得Cl2
方案:加热条件下二氧化锰与浓盐酸反应制得Cl2
![]() 方案:浓盐酸与氯酸钾固体反应制得Cl2
方案:浓盐酸与氯酸钾固体反应制得Cl2
![]() 方案:电解饱和食盐水法制得Cl2
方案:电解饱和食盐水法制得Cl2
现实验室有供选择的如下几种仪器来制取Cl2
 | |||||||
 | |||||||
 | |||||||
 |  | ||||||
①用上述仪器不能实现的方案为 。不考虑固定装置的仪器,可行但缺仪器的方案是 ,所缺的仪器是 。
若按b方案制Cl2时发生化学方程为_________________,
②若要设计联合实验探究氯气的漂白原理,从制备装置中产生氯气后应连接的装置中所使用的试剂或用品依次是____。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。为完成测定并验证有NO生成,有人设计下图实验装置。
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是________________________________________________。
(2)装置B瓶的作用是___________________________________________。
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人_______________(填“冷”或“热”)的氧气。
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是:___________________________________________________。
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1。实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________。
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程_______________ ____。
【解析】本实验的目的有两个。一是验证反应中除生成NO2气体外还有少量的NO生成,二是测定某铜银合金中铜的质量分数,解题时我们始终围绕这两个目的。要验证有NO生成,就必须要保证整个装置中没有氧气存在,否则即使生成NO,也会转变成NO2,所以实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是排尽装置中的空气。检验NO的方法是将NO与O2反应生成红棕色的NO2,由于反应中本来就生成NO2,所以必须将NO2与NO分离,结合题目不难得到装置C的作用就是将NO2转变成无色N2O4液体或晶体。如果温度过低NO2会转变成无色N2O4液体或晶体,所以为了便于观察应通人热的氧气。要测定某铜银合金中铜的质量分数除知道铜银合金的质量外,还必须测得与铜银合金相关的另外一个量,方可列方程组求解。结合题意,可知方法为测出氮的氧化物的质量。由于氮的氧化物存在于C、E两个装置中,所以必须测出两个装置的质量变化。另为保证测定准确,在A中反应完成和D中出现现象后,还应打开K1、K2,持续一段时间的N2和O2,以保证氮的氧化物被充分吸收。计算参加反应的硝酸的物质的量可以利用原子守恒进行计算,反应后剩余硝酸是0.04mol,反应前硝酸是0.04L×13.5mol/L=0.54mol,剩余参加反应的硝酸是0.5mol。因为溶液中含有银离子,剩余可以通过沉淀法来测定银的物质的量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com