
| A、240 mL 0.2 mol?L-1的NaCl溶液配制:需要使用天平、250 mL容量瓶等仪器 |
| B、向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可制备Fe(OH)3胶体 |
| C、不慎将NaOH溶液溅到皮肤上,应立即用较多的水冲洗 |
| D、用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出 |


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、0.336升 |
| B、0.224升 |
| C、0.896升 |
| D、1.12升 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 试 剂 | 保 存 方 法 | 理 由 |
| A | 固体NaOH | 存放在带橡胶塞的广口瓶中 | 防止接触空气被氧化 |
| B | Na2CO3晶体 | 存放在干燥密闭的广口瓶中 | 防止风华呈粉末 |
| C | Na | 保存在乙醇中 | 防止和氧气、水反应 |
| D | AgNO3溶液 | 保存在无色玻璃塞的试剂瓶中,放在阴暗处 | 防止见光分解 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
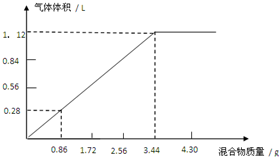 在硝酸铵和硫酸铵的固体混合物中加入50mL NaOH溶液,充分加热反应,混合的质量与产生的气体的体积如图所示.
在硝酸铵和硫酸铵的固体混合物中加入50mL NaOH溶液,充分加热反应,混合的质量与产生的气体的体积如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
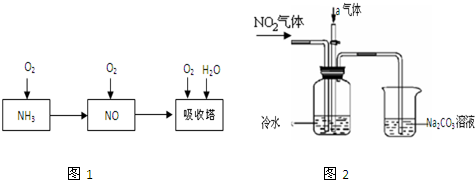
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸为弱电解质 |
| B、该溶液1 mL稀释至100 mL后,pH小于3 |
| C、向该溶液中加入等体积、等浓度的氢氧化钡溶液,混合后溶液pH=7 |
| D、该溶液中水电离出的c(H+)=1×10-13 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com