
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿的主要成份是FeS2。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_______________________________。
(2)第Ⅱ步中硫铁矿中的S被氧化到最高价态,相应的离子方程式为______________________。
(3)第Ⅱ步中检验Fe3+是否被完全还原的实验方法是____________________________________。
(4)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽。通入空气引起溶液pH降低的原因是_________________________。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S,正极反应式是________________。
【答案】Fe2O3+6H+===2Fe3++3H2O FeS2+14Fe3++8H2O===15Fe2++16H++2SO42— 取少量溶液于一洁净试管中,向其中加入少量KSCN溶液,若溶液不出现红色,则Fe3+被完全还原,否则没有 Fe2+被氧化为Fe3+,Fe3+水解产生H+。(或写出方程式4Fe2++O2+10H2O=4Fe(OH)3↓+8H+) FeS2+4Li++4e-===Fe+2Li2S或FeS2+4e-===Fe+2S2-
【解析】
试题本题以硫铁矿烧渣为原料制备FeSO4的流程为载体,考查方程式的书写,Fe3+的检验,Fe3+的氧化性和Fe3+的水解,电极反应式的书写。
(1)第I步H2SO4与Fe2O3反应生成Fe2(SO4)3和H2O,反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O。
(2)第I步获得的滤液为Fe2(SO4)3,第II步加入活化硫铁矿,硫铁矿中的S被氧化到最高价态,即硫铁矿中的S被氧化成SO42-,则Fe3+被还原成Fe2+,写出主要反应物和生成物:FeS2+Fe3+→Fe2++SO42-,在反应中S元素的化合价由-1价升至+6价,FeS2中两个S共升高14价,Fe元素的化合价由+3价降至+2价,根据元素化合价升降总数相等配平:FeS2+14Fe3+→15Fe2++2SO42-,根据原子守恒和溶液呈酸性配平,FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(3)检验Fe3+是否被完全还原用KSCN溶液,实验方法是:取少量溶液于一洁净试管中,向其中加入少量KSCN溶液,若溶液不出现红色,则Fe3+被完全还原,否则没有。
(4)通入空气会将溶液中Fe2+氧化成Fe3+,Fe3+水解产生H+,溶液的pH下降。反应的方程式为4Fe2++O2+10H2O=4Fe(OH)3+8H+。
(5)分析电池总反应,Li元素的化合价由0价升至+1价,负极反应式为Li-e-=Li+;Fe元素的化合价由+2价降至0价,S元素的化合价由-1价降至-2价,1molFeS2得到4mol电子,正极反应式为FeS2+4e-=Fe+2S2-。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】制取肥皂的实验有以下步骤:
①在一个干燥的蒸发皿中加入植物油8mL、乙醇8mL、NaOH溶液4mL
②在不断搅拌下,给蒸发皿中液体微微加热,直到混合物变稠
③继续加热,直到皂化反应完成
④把盛混合物的蒸发皿放在冷水浴中冷却.等待片刻,向混合物中加20mL热蒸馏水,再放在冷水中冷却.然后加入25mL NaCl饱和溶液充分搅拌
⑤用纱布滤出固体物质,弃去滤液.把固体物质挤于、压成条状、晾干,即得肥皂
根据实验,填空:
(1)在制肥皂时加入乙醇是利用了乙醇的什么性质?_________;
(2)如何验证皂化反应已完成?_________;
(3)在操作④中加入饱和NaCl溶液的作用是_________;
(4)写出硬脂酸甘油酯发生皂化反应的化学方程式_________;
(5)取用蒸发皿用的仪器是_________;
(6)工业上大规模生产用水蒸气加热的优点_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或做法正确的是
A.液氯是混合物,氯水是纯净物
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.铝比铁活泼,所以铝比铁更容易被腐蚀
D.CO2通入可溶性硅酸盐中析出硅酸胶体,所以硅酸的酸性小于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中可用如图制备乙炔,回答下列问题
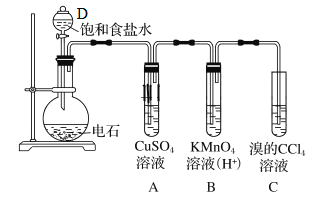
(1)仪器D名称_______________________。
(2)制取乙炔的化学方程式_______________________________________________。
(3)试管A观察到的现象_______________________。
(4)写出C发生的化学方程式______________________________________________。
(5)若没有A装置,观察到B褪色,且有浅黄色浑浊,请写出生成浅黄色浑浊的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Cl溶于重水(D2O)后,溶液中存在的一水合氨和水合氢离子可能是( )
A.NH3HDO和D3O+B.NH3HDO和HD2O+C.NH3H2O和H2DO+D.以上都有可能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农生产中有着重要的应用,请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ·mol-1
②1/4CaSO4(s)+CO(g)=1/4CaS(s)+CO2(g) △H=-47.3kJ·mol-1
反应:CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g) △H=_____________kJ·mol-1
(2)下图为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系。
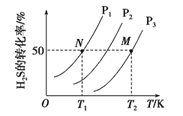
该反应平衡常数的大小关系为K(T1) ____K(T2)(填“>”、“=”或“<”),理由是____。用各物质的平衡分压代替平衡浓度表示反应的平衡常数,记为Kp,计算该反应在T1温度下的Kp=_________(用p1表示)。
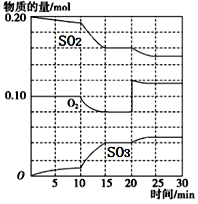
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g) ![]() 2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________(用文字表达);10min到15min的曲线变化的原因可能是________(填写编号)。
2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________(用文字表达);10min到15min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO2的物质的量
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应其△H=-122 kJ/mol,S=231 J/(mol·K),则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行B.在任何温度下都不能自发进行
C.仅在高温下自发进行D.仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
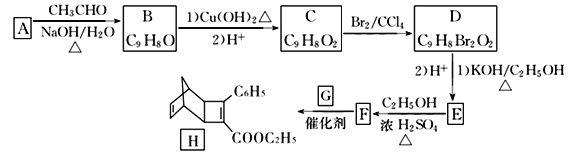
已知:①RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1)A的化学名称是____________,D中含有的官能团名称为_______________________。
(2)由F生成H的反应类型是_______________。
(3)G为甲苯的同分异构体,G的结构简式为_________________。
(4)由D生成E第(1)步的化学方程式为:____________________________________________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液放出CO2, 其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。符合要求的X有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。

(1)验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、________________、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。②铜与浓硫酸反应的化学方程式是________________,装置A中试剂是_______。③能说明碳的非金属性比硅强的实验现象是_______________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是____________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应的位置______。

写出其中SO2显示还原性生成沉淀的离子方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com