
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
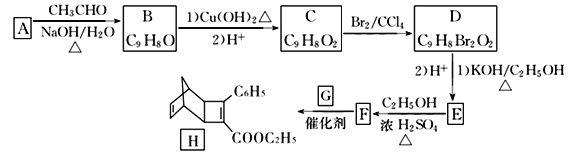
已知:①RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1)A的化学名称是____________,D中含有的官能团名称为_______________________。
(2)由F生成H的反应类型是_______________。
(3)G为甲苯的同分异构体,G的结构简式为_________________。
(4)由D生成E第(1)步的化学方程式为:____________________________________________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液放出CO2, 其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。符合要求的X有____种。
【答案】苯甲醛 溴原子、羧基 加成反应 
 4
4
【解析】
试题本题考查有机推断,涉及有机物的名称,官能团的识别,有机反应类型的判断,有机方程式的书写,限定条件同分异构体种类的确定。A是芳香化合物,B的分子式为C9H8O,B的不饱和度为6,B与新制Cu(OH)2反应后酸化生成C(C9H8O2),B中含醛基,根据A→B所加试剂(CH3CHO)和反应条件(NaOH/H2O并加热),结合题给已知①,可推知A的结构简式为![]() ,B的结构简式为
,B的结构简式为![]() ;B与新制Cu(OH)2反应后酸化得到的C的结构简式为
;B与新制Cu(OH)2反应后酸化得到的C的结构简式为![]() ;C与Br2/CCl4发生加成反应生成D,D的结构简式为
;C与Br2/CCl4发生加成反应生成D,D的结构简式为![]() ;D在KOH/C2H5OH中加热发生消去反应,消去产物酸化后得到E,E的结构简式为
;D在KOH/C2H5OH中加热发生消去反应,消去产物酸化后得到E,E的结构简式为![]() ;E与C2H5OH发生酯化反应生成F,F的结构简式为
;E与C2H5OH发生酯化反应生成F,F的结构简式为![]() 。
。
(1)A的结构简式为![]() ,A的名称为苯甲醛。D的结构简式为
,A的名称为苯甲醛。D的结构简式为![]() ,D中含有的官能团的名称为溴原子、羧基。
,D中含有的官能团的名称为溴原子、羧基。
(2)F+G→H,对比F和H的结构简式,F生成H发生题给已知②的反应,反应类型为加成反应。
(3)G是甲苯的同分异构体,G的分子式为C7H8,F+G→H发生题给已知②的反应,对比F和H的结构简式推知G的结构简式为 。
。
(4)D生成E的第(1)步反应为溴原子的消去反应和羧基的中和反应,反应的化学方程式为![]() +3KOH
+3KOH![]()
![]() +2KBr+3H2O。
+2KBr+3H2O。
(5)F的结构简式为![]() ,F的不饱和度为7,分子式为C11H10O2,X是F的同分异构体,X能与饱和NaHCO3溶液反应放出CO2,X中含羧基,X的核磁共振氢谱有4种不同化学环境的氢且峰面积比为6:2:1:1,符合要求的X的结构简式有
,F的不饱和度为7,分子式为C11H10O2,X是F的同分异构体,X能与饱和NaHCO3溶液反应放出CO2,X中含羧基,X的核磁共振氢谱有4种不同化学环境的氢且峰面积比为6:2:1:1,符合要求的X的结构简式有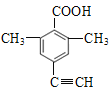 、
、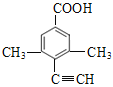 、
、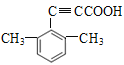
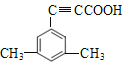 ,共4种。
,共4种。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿的主要成份是FeS2。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_______________________________。
(2)第Ⅱ步中硫铁矿中的S被氧化到最高价态,相应的离子方程式为______________________。
(3)第Ⅱ步中检验Fe3+是否被完全还原的实验方法是____________________________________。
(4)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽。通入空气引起溶液pH降低的原因是_________________________。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S,正极反应式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中 A.B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位,请回答问题:
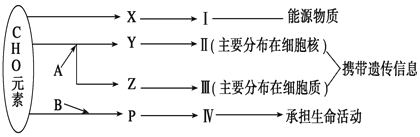
(1)图中X被形容为“生命的燃料”,它是____________,Ⅰ在小麦种子中主要是指____________。
(2)A和B各表示__________ 元素 和______________元素。
(3)Y完全水解的产物是__________、 _____________ 和 ________________。
(4)P的结构通式是____________________,P的种类有_____________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)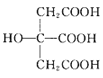 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
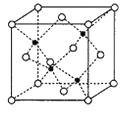
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 1 mol·L-1的K2SO4溶液中含有2 mol K+
B. 1 mol Cl2完全溶于水转移电子数为NA
C. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为4NA
D. 20 g T2O中含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与工业紧密相连,下列说法正确的是( )
A.金属钠由于很容易与氧气反应,因此无法用来冶炼金属
B.电解法、热还原法都可以用来冶炼金属铜
C.增大压强对于合成氨和三氧化硫的合成都是有利的,因此反应设备都需要耐高压
D.石灰水中通入氯气是用于工业合成漂白粉的有效手段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的![]() (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关
(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关![]() 的说法正确的是
的说法正确的是

A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g该物资含有6.02×![]() 个原子
个原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com