
【题目】光催化技术是一种在能源和环境领域有着重要应用前景的绿色技术。Ti的某种晶型的氧化物M可用作光催化材料。
(1)基态Ti原子的价层电子排布图为________。
(2)在第四周期d区元素中,与Ti 原子未成对电子数相同的元素名称是________。
(3)金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为_____。

(4)生活环境中的臭气源有氨气、甲硫醇(CH3-SH) 等,M 可以作为高效除臭剂。与氨气互为等电子体的阳离子为_____,甲硫醇中硫原子采取的杂化方式为_____,与S位于同一周期,且第一电离能小于S 的非金属元素符号为______,已知甲硫醇熔沸点小于甲醇(CH3OH),试解释此差异的主要原因___________。
(5)M 的晶胞结构如图2,M 化学式为______。
(6)石墨烯是单个原子厚度的二维碳纳米材料( 如图3),其比表面积大( 比表面积指单位质量物料所具有的总面积)。石墨烯与M 的结合使用,极大地提高了M 的光催化效果。在石墨烯晶体中,每个最小的六元环占有____个C 原子。已知石墨烯中C-C 键长为a pm,则单层石墨烯的比表面积为_____m2/g(NA表示阿伏伽德罗常数的数值,忽略碳原子的厚度)。
【答案】 ![]() 镍 D H3O+ sp3 Si 甲醇分子间有氢键 TiO2 2
镍 D H3O+ sp3 Si 甲醇分子间有氢键 TiO2 2 ![]()
【解析】(1)Ti原子序数为22,根据能级图及能量构造原理可得核外电子排布式为1s22s22p63s23p63d24s2,其价层电子排布式为3d24s2,电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2) Ti原子未成对电子数为2,在第四周期d区元素中,与Ti原子未成对电子数相同的元素的电子排布式为1s22s22p63s23p63d84s2,为镍元素,故答案为:镍;
(3)根据金属钛的原子堆积方式可知,该堆积方式为ABABABAB……镁型堆积,晶胞结构为![]() ,金属钛晶胞俯视图为D,故答案为:D;
,金属钛晶胞俯视图为D,故答案为:D;
(4)与氨气互为等电子体的阳离子有H3O+,甲硫醇(CH3-SH)中硫原子与2个原子相连,含有2个孤电子对,采取sp3杂化;同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,与S位于同一周期,且第一电离能小于S的非金属元素符号为Si,甲醇分子间有氢键,甲硫醇不能形成氢键,因此甲硫醇熔沸点小于甲醇(CH3OH),故答案为:H3O+;sp3;Si;甲醇分子间有氢键;
(5)根据M的晶胞结构,O原子数目=2+4×![]() =4,Ti原子数目=1+8×
=4,Ti原子数目=1+8×![]() =2,则M化学式为TiO2,故答案为:TiO2;
=2,则M化学式为TiO2,故答案为:TiO2;
(6) 根据图示,六元环的每个顶点被3个六元环共用,在石墨烯晶体中,每个最小的六元环占有的碳原子数=6×![]() =2;12g石墨烯(即1mol)实际占有的六边形的个数为
=2;12g石墨烯(即1mol)实际占有的六边形的个数为![]() NA,所以算得12g石墨烯的总面积为
NA,所以算得12g石墨烯的总面积为![]() NA×
NA×![]() ×(
×(![]() a×1012)×(a×1012)×6×2=
a×1012)×(a×1012)×6×2=![]() NA×1024m2,则单层石墨烯的比表面积为
NA×1024m2,则单层石墨烯的比表面积为![]() =
=![]() NA×1024m2/g,故答案为:
NA×1024m2/g,故答案为:![]() NA×1024。
NA×1024。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯  (g)+CO2(g)
(g)+CO2(g) 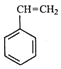 (g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行 A.
(g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行 A.  (g)
(g)  (g)+H2(g)△H1=﹣125KJ/mol
(g)+H2(g)△H1=﹣125KJ/mol
B.H2(g)+CO2(g)CO(g)+H2O(g)△H2=﹣41KJ/mol
(1)上述乙苯与CO2反应的反应热△H为
(2)苯乙烯与HCl加成的产物中具有手性异构体的分子的结构简式为 .
(3)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验I在T1℃,0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示. 
①实验I乙苯在0﹣50min时的反应速率为
②实验Ⅱ可能改变条件的是
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(4)25℃时,将体积为Va PH=a的某一元强碱与体积为Vb PH=b的某二元强酸混合.若所得混合溶液的pH=11,且a=13,b=2,则Va:Vb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H 是一种免疫调节剂,其合成流程如下:

问答下列问题:
(1)H所含官能团有氨基、羟基和______________。
(2)X的化学式为_______________,③的反应类型是_____________。
(3)设计反应①和⑤的目的是__________________。
(4)反应①为取代反应,其化学方程式为________________。
(5)R的同分异构体M同时满足下列条件:
①M 能与氯化铁溶液发生显色反应
②1molM 最多能和4molNaOH 发生反应
③在核磁共振氢谱上有四组峰且峰的面积之为3:3:2:2
M 的结构简式可能为________________。
(6)已知: ,结合上述相关信息,以
,结合上述相关信息,以 为原料设计合成路线合成
为原料设计合成路线合成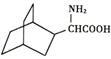 _________(其他试剂自选)。
_________(其他试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.光照新制的氯水时,溶液的pH逐渐减小
B.工业生产中,500℃左右比常温下更有利于合成氨
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.增大压强,有利于SO2和O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的曲线是表示其他条件一定时,2NO(g)+O2(g) ![]() 2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
A.a点
B.b点
C.c点
D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应xA(g)+yB(g) ![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) ![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列装置制备无水AlCl3(183℃升华),无水AlC13遇潮湿空气即产生大量白雾。下列说法错误的是

A. b、c、f中依次盛装饱和食盐水、浓硫酸、浓硫酸
B. g中发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O
C. e装置的收集器必须保持干燥
D. 实验时,a和d处酒精灯应同时点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中的①~⑨中元素,用元素符号或化学式填空回答:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为。
(2)地壳中含量最多的金属元素是。
(3)②与④形成的化合物的电子式。
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是 , 呈两性的氢氧化物是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com