
下列有关溶液中粒子浓度的关系式中,正确的是( )
A.pH相同的①CH3COONa、②NaHCO3两种溶液中的c(Na+):②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
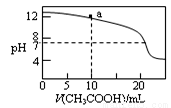
C.上图表示用0.1 mol/L CH3COOH溶液滴定20 mL 0.1mol/L NaOH溶液的滴定曲线,则pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.上图a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年江西省高一下第三次考试化学试卷(解析版) 题型:选择题
天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为: CH4+ 2O2→CO2+ 2H2O, C3H8+ 5O2→3CO2+4H2O ,现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是
A.增大空气进入量或减小石油气进入量
B.增大空气进入量,增大石油气进入量
C.减小空气进入量,减小石油气进入量
D.减小空气进入量或增大石油气进入量
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三十二模理科化学试卷(解析版) 题型:实验题
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3 = Na2CO3 + CO2↑+ H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 .
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
查看答案和解析>>
科目:高中化学 来源:2016届甘肃西北师大附中高三下第五次诊断理科化学试卷(解析版) 题型:实验题
甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(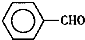 )、苯甲酸(
)、苯甲酸( )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
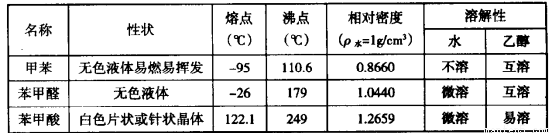
注:甲苯、苯甲醛、苯甲酸三者互溶; 酸性: 苯甲酸>醋酸
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是____ ____,主要作用是 。三颈瓶中发生反应的化学方程式为 ,此反应的原子利用率理论上可达 。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________。
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取1.200g产品,溶于100mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为________。
③下列情况会使测定结果偏低的是__________(填字母)。
a.滴定终点时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配制KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北武邑中学高一下第二次月考化学试卷(解析版) 题型:简答题
I.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度= ,
(2)B的平均反应速率v(B)= ,
(3)x= ,
(4)开始时容器中的压强与平衡时的压强之比为 (化为最箭整数比)
II.将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)
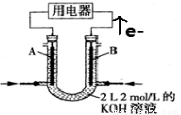
(5) (填A或B)处电极入口通甲烷,其电极反应式为 ;
(6)当消耗甲烷的体积为11.2 L(标准状况下)时,则消耗KOH的物质的量为 。
(7)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4gNH3转移的电子数目为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北武邑中学高一下第二次月考化学试卷(解析版) 题型:选择题
在一定温度下的恒容密闭容器中,当下哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④气体的总物质的量
⑤混合气体的平均相对分子质量
⑥物质C的百分含量
⑦各气体的物质的量
A.②③⑤⑥⑦ B.①②③⑥⑦ C.②③④⑤⑥ D.①③④⑤⑦
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北大附中河南分校高一下期末化学试卷(解析版) 题型:选择题
要检验某溴乙烷中的溴元素,正确的实验方法是( )
A.加入溴水振荡,观察水层是否有棕红色出现
B.滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成
D.加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下第二次月考化学试卷(解析版) 题型:填空题
某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为________。
(2)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为________,金属晶体K的堆积方式为________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为______
__________________________________。
(5)100 g上述产气药剂产生的气体通过碱石灰后得到N2 33.6 L(标准状况)。
①用碱石灰除去的物质为________________;
②该产气药剂中NaN3的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com