
【题目】尿素[CO(NH2)2]是含氮量最高的氮肥。
(1) 已知工业上合成尿素的反应分为如下两步:
第1步:2NH3(I)+CO2(g) ![]() H2NCOONH4(I) H1=-330.0kJ·mol-1
H2NCOONH4(I) H1=-330.0kJ·mol-1
第2步:H2NCOONH4(I) ![]() H2O(I)+CO(NH2)2(I) H2=+226.3 kJ·mol-1
H2O(I)+CO(NH2)2(I) H2=+226.3 kJ·mol-1
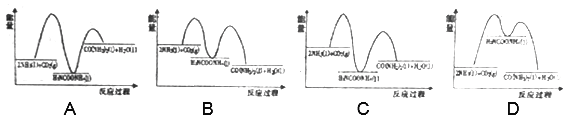
则下列各图能正确表示尿素合成过程中能量变化曲线的是___________(填字母编号)。
(2)一定条件下工业合成尿素的总反应:CO2(g)+2HH3(g) ![]() CO(NH2)2(g)+H2O(g),t℃时,向容积恒定为2L的密闭容器中加入0.20molCO2和0.80molNH3,反应中CO2的物质的量随时间变化如下表所示:
CO(NH2)2(g)+H2O(g),t℃时,向容积恒定为2L的密闭容器中加入0.20molCO2和0.80molNH3,反应中CO2的物质的量随时间变化如下表所示:
时间/min | 0 | 40 | 70 | 80 | 100 |
n(CO2)/mol | 0.20 | 0.12 | 0.10 | 0.10 | 0.10 |
①前40min内v(NH3)=_________,此温度下该反应的平衡常数为___________。
②30min时v正(CO2)________80min时v逆(H2O)(选填“>”、“=”、“<”)。
③在100min时,保持其它条件不变,再向容器中充入0.10molCO2和0.4molNH3,重新建立平衡后CO2的转化率与原平衡相比将________(填“增大”、“不变”、“减小”)
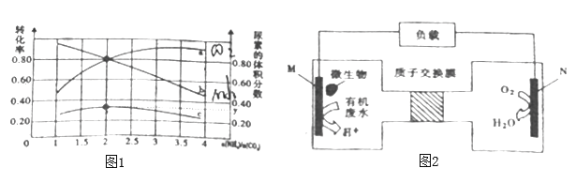
④氨碳比[n(NH3)/n(CO2)]对合成尿素有影响,恒温恒容条件下将总物质的量为3mol的NH3和CO2的混合气体按不同氨碳比进行反应,结果如图1所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平和体系中尿素的体积分数变化。[n(NH3)/n(CO2)]=______时,尿素产量最大,经计算图中y=_______(精确到0.01)。
(3)工业生成中为提高尿素的产率可采取的措施有___________________。
(4)近期科学家发现微生物可将生产废水中的尿素直接转化为对环境友好的两种物质,其工作原理如图2所示。回答下列问题:
①N极为_________极(填“正”、“负”),M电极反应式________________。
②N极消耗标准状况下33.6L气体时,M极理论上处理的尿素的质量为__________g。
【答案】 C 0.002moL·L-1min-1 0.556或![]() > 增大 2 0.36 增大反应物浓度、或增大压强、或定时分离出尿素,或其它合理答案,答出一点即可 正 CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ 60g
> 增大 2 0.36 增大反应物浓度、或增大压强、或定时分离出尿素,或其它合理答案,答出一点即可 正 CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ 60g
【解析】 (1)两步反应的完成的热效应与一步完成的热效应是相同的,将两个反应相加可得2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ·mol-1,第一步放热,第二步吸热,总反应是放热,对照图像,选C。(2)①前40min内v(NH3)=2v(CO2)==![]()
CO2(g)+2HH3(g) ![]() CO(NH2)2(g)+H2O(g),
CO(NH2)2(g)+H2O(g),
起始/mol 0.2 0.8
转化/mol 0.1 0.2 0.1 0.1
平衡/mol 0.1 0.6 0.1 0.1
![]()
②30min时正向进行速率减小后与80min时相等,故v正(CO2)> 80min时v逆(H2O)
③在100min时,保持其它条件不变,再向容器中充入0.10molCO2和0.4molNH3,相当于对原平衡进行加压,平衡正向进行,重新建立平衡后CO2的转化率与原平衡相比将原平衡增大;
④从图中读出[n(NH3)/n(CO2)]=2时,尿素产量最大,
CO2(g)+2HH3(g) ![]() CO(NH2)2(g)+H2O(g)
CO(NH2)2(g)+H2O(g)
始mol/L 1 2
变mol/L 0.8 1.6 0.8 0.8
平mol/L 0.2 0.4 0.8 0.8
平衡时CO(NH2)2 的体积分数![]()
(3)工业生成中为提高尿素的产率可采取的措施有增大反应物浓度、或增大压强、或定时分离出尿素,或其它合理答案,答出一点即可 ;
(4)①O2得电子,N极为正极,M电极反应式CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+;②N极消耗标准状况下33.6L气体时,转移电子6mol,由CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+可知,M极理论上处理的尿素的质量为1mol,即60g。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】下列关于Fe(OH)3胶体的说法中不正确的是:
A. Fe(OH)3胶体与食盐溶液混合将产生聚沉现象
B. Fe(OH)3胶体粒子在电场影响下将向阳极移动
C. 胶体中Fe(OH)3胶体粒子不停地作布朗运动
D. 光线通过Fe(OH)3胶体时会发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】〔化学——选修3:物质结构与性质〕举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为 ,第一电离能最大的元素为 。
(2)钛的原子序数为22,其基态电子排布式示意图为 。
(3)1 mol N2H4分子中含有的键数目为 。
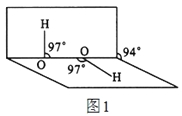
(4)H2O2分子结构如图1,其中心原子杂化轨道为 ,估计它难溶于CS2,简要说明原因 。
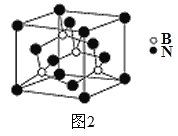
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为 ,若立方氮化硼的密度为g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或事故处理正确的是
A. 金属钠着火,立即用水扑灭
B. 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中
C. 实验结束后,用嘴吹灭酒精灯
D. 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
① C2H2(g) +5/2O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+ ![]() O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) == C2H2(g)的△H为( )
A. +228.2 kJ·mol-1 B. -228.2 kJ·mol-1
C. +1301.0 kJ·mol-1 D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金因坚硬、轻巧、美观、易于加工而成为被广泛应用的新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是
A. 不易生锈 B. 导电性好
C. 密度较小 D. 强度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
③取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀;
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如下图所示,

④取少量甲溶液于试管中,加入过最的NaOH溶液并加热。
回答下列问题:
(1)C的元素符号是_______,D在周期表中的位置是________。
(2)经测定甲晶体的摩尔质量为453 gmol-1,其中阳离子和阴离子物质的量之比为1:1,则甲晶体的化学式为________。
(3)实验③中根据图象得V(oa):V(ab):V(bc)= _______。
(4)实验④中离子方程式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com