
【题目】下列关于各装置图的叙述不正确的是
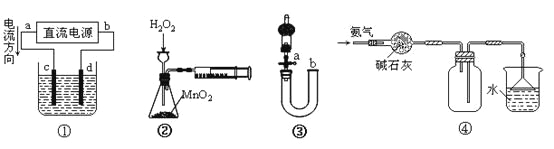
A.装置①中,c为阳极,d为阴极
B.装置②可定量测定H2O2的分解速率
C.关闭活塞a,从b处加水,可以检查装置③的气密性
D.装置④可用于收集并吸收多余的氨气
【答案】B
【解析】
A.装置①中, c电极与电源的正极连接,为阳极,d与电源的负极连接,为阴极,故A正确;
B.H2O2遇MnO2会分解产生O2,但是产生的氧气会从长颈漏斗中逸出,就不能准确测量氢气的体积,因此装置②不可定量测定H2O2的分解速率,故B错误;
C.关闭活塞a,从b处加水,若装置不漏气,则会在U型管的左右两端形成一段稳定的液差,故可以检查装置③的气密性,故C正确;
D.氨气是碱性气体,可以用碱石灰干燥,由于氨气的密度比空气小,所以用向下排空气的方法收集,由于氨气极容易溶于水,会引起倒吸现象的发生,为了防止倒吸的发生,在导气管的末端安装一个倒扣的漏斗,故装置④可用于收集并吸收多余的氨气,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)Z(g),经1min达到平衡,剩余![]() 。下列说法正确的是
。下列说法正确的是
A.以Z浓度变化表示的反应速率为0.005mol/(Ls)
B.若增大压强,则物质Y的转化率减小
C.当c(X):c(Y):c(Z)=2:1:1时,表明反应处于平衡状态
D.若保持恒温恒压条件下再通入1molX和1molY进行反应,则平衡时X的转化率将不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
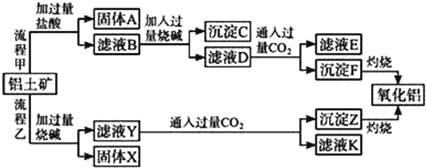
请回答下列问题:
(1)固体A的主要成分是______________(写名称).
(2)铝土矿与过量烧碱反应的离子方程式为______、______.
(3)电解熔融氧化铝可制得两种单质,写出该反应化学方程式______________.
(4)指出流程乙的一个缺点是____________.
(5)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。已知:①CO(g)+
CH3OH(g)。已知:①CO(g)+![]() O2(g)=CO2(g) △H1=-283.0kJ/mol
O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+![]() O2(g)=H2O(g) △H2=-241.8kJ/mol
O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g)![]() CH3OH(g)的反应热△H4=________________。
CH3OH(g)的反应热△H4=________________。
(2)若在绝热、恒容的密闭容器中充入1mol CO、2mol H2,发生CO(g)+2H2(g)![]() CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。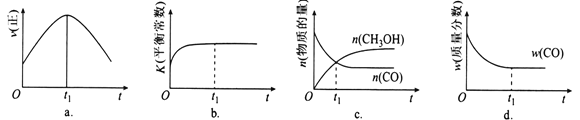
(3)T1℃时,在一个体积为5L的恒容容器中充入1mol CO、2mol H2,经过5min达到平衡,CO的转化率为0.8,则5min内用H2表示的反应速率为v(H2)=__________。T1℃时,CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=______________。
CH3OH(g)的平衡常数K=______________。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:_____________________。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,验证取代反应时,反应需用水浴加热的原因是_____;观察到________现象时,表明溴乙烷与NaOH溶液已完全反应。
(2)有机物A的分子式为C3H8O,它能氧化成B也能与浓硫酸共热生成C。若B不能发生银镜反应,C不能使溴水褪色。B含有的官能团名称为__________,C结构简式为:_____________。
(3)DAP是电器和仪表部件中常用的一种高分子材料,其结构如图:
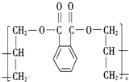
则合成它的单体是________(填序号)。
①邻苯二甲酸 ②丙烯 ③丙烯酸 ④邻苯二甲醇 ⑤丙烯醇
(4)![]() 的名称是(用系统命名法命名)_____________________。
的名称是(用系统命名法命名)_____________________。
(5)写出![]() 与足量溴水反应的化学方程式________。
与足量溴水反应的化学方程式________。
(6)写出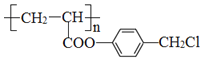 与足量NaOH溶液反应的化学方程式_____。
与足量NaOH溶液反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸置于恒容的密闭真空容器中(固体体积忽略不计),使其达到化学平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列有关叙述正确的是
A. 在低温下该反应能自发进行
B. 15℃时,该反应的化学平衡常数约为2.0
C. 当混合气体平均相对分子质量不变时,该反应达到化学反应限度
D. 恒温条件下,向原平衡体系中再充入2molNH3和1molCO2,达平衡后CO2浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中投入![]() 和
和![]() ,分别在温度
,分别在温度![]() 和
和![]() 下进行如下反应:
下进行如下反应:![]() ,且在
,且在![]() 温度下反应一段时间后改变某一个外界条件,测得
温度下反应一段时间后改变某一个外界条件,测得![]() 的物质的量
的物质的量![]() 与时间
与时间![]() 关系如下表所示,下列有关说法中错误的是( )
关系如下表所示,下列有关说法中错误的是( )
0 | 5min | 10min | 15min | 20min | 25min | |
| 2mol |
|
|
|
|
|
| 2mol |
|
|
|
|
|
A.![]()
B.![]()
C.![]() 温度下15min时改变的条件可能是加入一定量的He
温度下15min时改变的条件可能是加入一定量的He
D.![]() 温度下的平衡常数为12.96
温度下的平衡常数为12.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时.体积均为
时.体积均为![]() 的两个恒容密闭容器中发生可逆反应:
的两个恒容密闭容器中发生可逆反应:![]()
![]() 实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是
实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是![]()
容器编号 | 起始时各物质物质的量 | 达到平衡时体系能量的变化 | ||
A | B | C | ||
| 2 | 1 | 0 |
|
|
|
|
| |
A.容器![]() 、
、![]() 中的平衡常数均为36
中的平衡常数均为36
B.向容器![]() 中通入氦气,平衡时A的转化率不变
中通入氦气,平衡时A的转化率不变
C.容器![]() 中达到平衡时放出的热量为/span>
中达到平衡时放出的热量为/span>![]() QkJ,达到平衡时,两个容器中C的物质的量浓度均为
QkJ,达到平衡时,两个容器中C的物质的量浓度均为![]()
![]()
D.其他条件不变,若容器![]() 保持恒容绝热,则达到平衡时C的体积分数小于
保持恒容绝热,则达到平衡时C的体积分数小于![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com