
【题目】![]() 时.体积均为
时.体积均为![]() 的两个恒容密闭容器中发生可逆反应:
的两个恒容密闭容器中发生可逆反应:![]()
![]() 实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是
实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是![]()
容器编号 | 起始时各物质物质的量 | 达到平衡时体系能量的变化 | ||
A | B | C | ||
| 2 | 1 | 0 |
|
|
|
|
| |
A.容器![]() 、
、![]() 中的平衡常数均为36
中的平衡常数均为36
B.向容器![]() 中通入氦气,平衡时A的转化率不变
中通入氦气,平衡时A的转化率不变
C.容器![]() 中达到平衡时放出的热量为/span>
中达到平衡时放出的热量为/span>![]() QkJ,达到平衡时,两个容器中C的物质的量浓度均为
QkJ,达到平衡时,两个容器中C的物质的量浓度均为![]()
![]()
D.其他条件不变,若容器![]() 保持恒容绝热,则达到平衡时C的体积分数小于
保持恒容绝热,则达到平衡时C的体积分数小于![]()
【答案】B
【解析】
容器![]() 中参加反应的A的物质的量
中参加反应的A的物质的量![]() ,则:
,则:
![]()
起始![]() :2 1 0
:2 1 0
转化![]() :
:![]()
![]()
![]()
平衡![]() :
:![]()
![]()
![]()
恒温恒容下,![]() 中完全转化到方程式左边可以得到2molA、1mol,容器
中完全转化到方程式左边可以得到2molA、1mol,容器![]() 、
、![]() 反应为完全等效平衡,平衡时各组分的物质的量相等,
反应为完全等效平衡,平衡时各组分的物质的量相等,![]() 中A的起始物质的量为
中A的起始物质的量为![]() ,小于平衡时的
,小于平衡时的![]() ,故
,故![]() 中平衡逆向移动.
中平衡逆向移动.
A.由于温度相等,![]() 平衡常数相等,
平衡常数相等,![]() 中平衡常数
中平衡常数![]() ,故A错误;
,故A错误;
B.恒容条件下,向容器![]() 中通入氦气,各组分的浓度不变,平衡不移动,平衡时A的转化率不变,故B正确;
中通入氦气,各组分的浓度不变,平衡不移动,平衡时A的转化率不变,故B正确;
C.![]() 中反应吸收热量,容器
中反应吸收热量,容器![]() 、
、![]() 反应为完全等效平衡,平衡时B的物质的量相等,则
反应为完全等效平衡,平衡时B的物质的量相等,则![]() 中吸收的热量为
中吸收的热量为![]() ,平衡时C的浓度为
,平衡时C的浓度为![]() ,故C错误;
,故C错误;
D.平衡时![]() 、
、![]() 中C的体积分数为
中C的体积分数为![]() ,其他条件不变,若容器
,其他条件不变,若容器![]() 保持恒容绝热,随反应进行,温度降低,反应向生成C的方向移动,生成2molC时,混合气体减小1mol,则达到平衡时C的体积分数大于
保持恒容绝热,随反应进行,温度降低,反应向生成C的方向移动,生成2molC时,混合气体减小1mol,则达到平衡时C的体积分数大于![]() ,故D错误,
,故D错误,
故选B。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】下列关于各装置图的叙述不正确的是
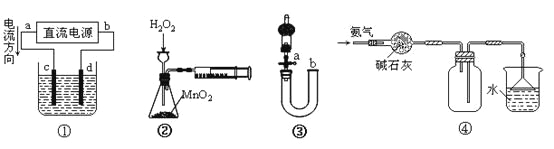
A.装置①中,c为阳极,d为阴极
B.装置②可定量测定H2O2的分解速率
C.关闭活塞a,从b处加水,可以检查装置③的气密性
D.装置④可用于收集并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种新型硝化剂,在一定温度下可发生如下反应:
是一种新型硝化剂,在一定温度下可发生如下反应:![]() ,
,![]() 温度时,向密闭容器中通入
温度时,向密闭容器中通入![]() 气体,部分实验数据见下表:
气体,部分实验数据见下表:
时间 | 0 | 500 | 1000 | 1500 |
|
|
|
|
|
下列说法正确的是
A.500s内![]() 的生成速率为
的生成速率为![]()
B.![]() 温度下该反应平衡时
温度下该反应平衡时![]() 的转化率为
的转化率为![]()
C.达平衡后其他条件不变,将容器体积压缩到原来的![]() ,
,![]()
D.![]() 温度下的平衡常数为
温度下的平衡常数为![]() ,
,![]() 温度下的平衡常数为
温度下的平衡常数为![]() ,若
,若![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代人追求“低碳生活” ,二氧化碳的回收并利用是环保领域研究的热点和重点。试分析并回答:
(1)有一最新美国科学家的研究成果,利用金属钛和某些装置等,模仿太阳的蓝色波长,使CO2慢慢发生人工“光合作用” 后,被还原成太阳能燃料——甲酸等,该化学方程式是_____________________________;
(2)另有一种用CO2生产甲醇燃料的方法:
CO2+3H2=CH3OH+H2O。已知298 K和101 kPa条件下:
CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ΔH=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热ΔH=________。
(3)工业上合成尿素的反应如下:
2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(l) ΔH<0,某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2∶1的物质的量之比充入一体积为10 L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20 min达到平衡,各物质浓度的变化曲线如图所示。
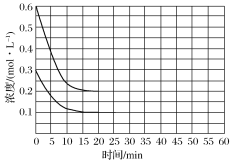
①为提高尿素的产率,下列可以采取的措施有________;
A.缩小反应容器的容积
B.升高温度
C.平衡体系中分离出部分CO(NH2)2
D.使用合适的催化剂
②若保持平衡的温度和压强不变,再向容器中充入3 mol的氨气,则此时v正________v逆(填“>”“=”或“<”),判断理由_____________________________;
③若保持平衡的温度和体积不变,25 min时再向容器中充入2 mol氨气和1 mol二氧化碳,在40 min时重新达到平衡,请在上图中画出25~50 min内氨气的浓度变化曲线________________。
(4)多孔Al2O3薄膜可作为催化剂载体、模板合成纳米材料等用途。现以高纯铝片作为阳极,不锈钢作为阴极,一定溶度的磷酸溶液作为电解质进行电解,即可初步制取多孔Al2O3膜。请写出该制取过程的阳极电极反应:__________________________________________。
(5)要实现CO2直接加H2合成汽油,关键是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价电子排布式为_______,基态氧原子的价层电子排布式不能表示为2s22px22py2,因为这违背了_______原理(规则)。
(2)[B(OH)4]-中硼原子的杂化轨道类型为______,氧原子的价层电子对互斥模型是_____。[Sn(OH)6] 2-中,Sn与O之间的化学键不可能是_____。
a.π键 b.σ键 c.配位键 d.极性键
(3)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式_______,并写出一种与氨硼烷互为等电子体的分子_______(填化学式)。
(4)已知硼酸(H3BO3)为一元弱酸,写出硼酸表现一元弱酸性的电离方程式________。
(5)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较高的是_______(填化学式),其原因是___________。
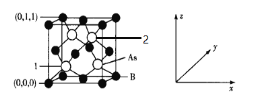
(6)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则2号砷原子的坐标为______。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______g·cm-3(列出含a、NA的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.实验室用浓盐酸与MnO2制备氯气:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
D.过氧化钠与水反应:2Na2O2+2H2O=4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]() ,实验内容和结果分别如表和图所示,下列说法不正确的是( )
,实验内容和结果分别如表和图所示,下列说法不正确的是( )
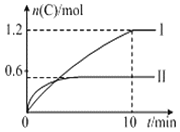
实验序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
I |
| 1mol | 3mol | 96kJ |
II |
|
|
| |
A.实验Ⅰ中,10min内平均速率![]()
![]()
B.上述方程式中![]()
C.![]() 时,该反应的平衡常数是
时,该反应的平衡常数是![]()
D.向实验Ⅱ的平衡体系中再充入![]() molA和
molA和![]() molB,A的转化率增大
molB,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
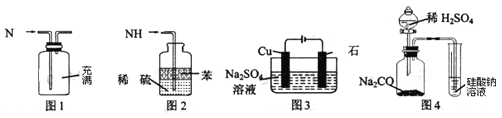
A.用图1所示装置可收集NO气体
B.用图4装置可证明酸性:H2SO4>H2CO3>H2SiO3
C.用图3所示装置可实现反应:2H2O![]() O2↑+2H2↑
O2↑+2H2↑
D.用图2所示装置可吸收多余氨气且能防止倒吸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com