
【题目】下列反应的离子方程式不正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.实验室用浓盐酸与MnO2制备氯气:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
D.过氧化钠与水反应:2Na2O2+2H2O=4OH-+O2↑
【答案】BD
【解析】
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体,生成的Fe(OH)3胶体不拆,正确的离子反应方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故A正确;
Fe(OH)3(胶体)+3H+,故A正确;
B. 用小苏打治疗胃酸过多,小苏打的为碳酸氢钠,胃酸为盐酸,原理为碳酸氢钠与盐酸反应,反应的离子反应方程式为: HCO3-+H+=CO2↑+H2O,碳酸氢根不能拆,故B错误;
C. 实验室用浓盐酸与MnO2制备氯气,反应原理为二氧化锰与浓盐酸在加热条件下反应生成氯气,反应的离子反应方程式为:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑,故C正确;
Mn2++2H2O+Cl2↑,故C正确;
D. 过氧化钠与水反应生成氢氧化钠,氢氧化钠可以拆,正确的离子反应方程式为:2Na2O2+2H2O=4Na+ +4OH-+O2↑,故D错误;
综上所述,正确答案为BD。


科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸置于恒容的密闭真空容器中(固体体积忽略不计),使其达到化学平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列有关叙述正确的是
A. 在低温下该反应能自发进行
B. 15℃时,该反应的化学平衡常数约为2.0
C. 当混合气体平均相对分子质量不变时,该反应达到化学反应限度
D. 恒温条件下,向原平衡体系中再充入2molNH3和1molCO2,达平衡后CO2浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用NH3·H2O溶液做导电性实验,灯泡很暗,说明NH3·H2O是弱电解质
B.等体积的pH都为2的酸HA和HB分别与足量的铁粉反应,HA放出的H2多,说明HA酸性强
C.c=0.1 mol·L-1的CH3COOH溶液和c=0.1 mol·L-1的HCl溶液中,前者的pH大
D.常温下,pH=5的CH3COOH溶液和pH=4的HCl溶液中,c(CH3COO-)/c(Cl-)=1/10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时.体积均为
时.体积均为![]() 的两个恒容密闭容器中发生可逆反应:
的两个恒容密闭容器中发生可逆反应:![]()
![]() 实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是
实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是![]()
容器编号 | 起始时各物质物质的量 | 达到平衡时体系能量的变化 | ||
A | B | C | ||
| 2 | 1 | 0 |
|
|
|
|
| |
A.容器![]() 、
、![]() 中的平衡常数均为36
中的平衡常数均为36
B.向容器![]() 中通入氦气,平衡时A的转化率不变
中通入氦气,平衡时A的转化率不变
C.容器![]() 中达到平衡时放出的热量为/span>
中达到平衡时放出的热量为/span>![]() QkJ,达到平衡时,两个容器中C的物质的量浓度均为
QkJ,达到平衡时,两个容器中C的物质的量浓度均为![]()
![]()
D.其他条件不变,若容器![]() 保持恒容绝热,则达到平衡时C的体积分数小于
保持恒容绝热,则达到平衡时C的体积分数小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Diels-Alder 反应的原理:![]() 。化合物Z可通过如下反应制备:
。化合物Z可通过如下反应制备:
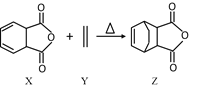
下列说法正确的是
A.化合物X中所有的碳原子共平面
B.化合物Z也可以用 ![]() 和
和 ![]() 来制备
来制备
C.1mol化合物Z可与3mol H2发生加成反应
D.化合物X的同分异构体中含有羧基的芳香族化合物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为_____________________________________。
(2)下列实验能比较镁和铝的金属性强弱的是____________(填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/L AlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是_____________________________。
(4)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是_________ mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应______(填“增大”、“减小”或“不变”)。
(5)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=_______________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为______以上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为某种聚甲基丙烯酸酯纤维(M)的单体,其转化关系如图:
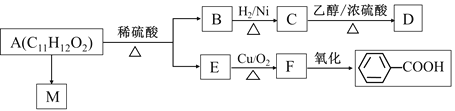
回答下列问题:
(1)B中含氧官能团的结构简式为_______;C用系统命名法命名为___________________。
(2)反应A→M的反应类型为___________;M的结构简式为___________________________。
(3)反应C→D的化学方程式为_______________________________。F与银氨溶液反应的化学方程式为________________________。
(4)关于E的下列说法正确的是________________(填写序号)。
①分子中所有碳原子都在同一平面上;
②能与H2反应;
③能与NaOH的醇溶液反应;
④能与溴水反应。
(5)写出满足下列条件的A的同分异构体的结构简式:______________________。
①与A具有相同的官能团;
②水解产物之一(相对分子质量为108)遇FeCl3溶液显紫色;
③核磁共振氢谱有5种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物![]() 如图所示
如图所示![]() ,发生反应:
,发生反应:![]() 保持温度不变,测得平衡时的有关数据如下:
保持温度不变,测得平衡时的有关数据如下:
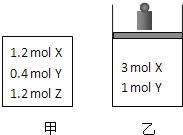
恒容容器甲 | 恒压容器乙 | |
Y的物质的量 |
|
|
Z的体积分数 |
|
|
下列说法正确的是![]()
A.平衡时容器乙的容积一定比反应前小
B.![]()
C.![]()
D.平衡时容器甲的压强一定比反应前大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是
A. Na2S 溶液中 c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
B. Na2CO3溶液中:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
C. 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,溶液中离子浓度的大小顺序:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. pH=4的0.1molL﹣1NaHC2O4溶液中c(H C2O4﹣)>c(H+)>c(H2C2O4)>c(C2O42﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com