
【题目】氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为_____________________________________。
(2)下列实验能比较镁和铝的金属性强弱的是____________(填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/L AlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是_____________________________。
(4)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是_________ mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应______(填“增大”、“减小”或“不变”)。
(5)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=_______________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为______以上。
【答案】2Al +2OH-+6H2O = 2 [Al(OH)4]- + 3H2↑c4Al (s)+ 3MnO2 (s) = 3Mn(s) +2Al2O3(s) ΔH=–1789 kJ/mol0.024减小c(Ce4+)[c(OH-)]48
【解析】
(1)Al与NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为:2Al +2OH-+6H2O = 2 [Al(OH)4]- + 3H2↑ ;正确答案: 2Al +2OH-+6H2O = 2 [Al(OH)4]- + 3H2↑。
(2)金属导电性强弱不能证明金属的金属性强弱,a错误;镁离子和铝离子浓度不同,无法比较水解的强弱,从而无法确定金属性强弱,b错误;氢氧化镁不溶于氢氧化钠,而氢氧化铝能够溶于氢氧化钠,说明氢氧化镁的碱性大于氢氧化铝,所以能比较两种金属的金属性的强弱,c正确;正确选项c。
(3)①4Al (s)+3O2(g) =2Al2O3(s) ΔH1=-3352 kJ/mol;②Mn(s)+ O2(g)=MnO2 (s) ΔH2=-521 kJ/mol根据盖斯定律可得①-②×3:Al与MnO2反应冶炼金属Mn的热化学方程式是4Al (s)+ 3MnO2 (s) = 3Mn(s) +2Al2O3(s) ΔH=–1789 kJ/mol;正确答案:4Al (s)+ 3MnO2 (s) =3Mn(s) +2Al2O3(s) ΔH=–1789 kJ/mol。
(4)①5.60gSi3N4(s)的物质的量为5.6/140=0.04mol,根据方程式可以知道参加反应的氢气的物质的量为0.04×6=0.24mol,故H2的平均反应速率是0.24/(2×5)=0.024 mol/(L·min);正确答案:0.024。
②按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,与原平衡投料配比相同,等效为增大压强,该反应正反应是气体体积增大的反应,增大压强,平衡向逆反应移动, SiCl4的转化率减小;因此,本题正确答案是:减小。
(5)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4![]() Ce4++4OH-,其溶度积表达式为Ksp=c(Ce4+)×[c(OH-)]4 ;为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,所以1×10-5×[c(OH-)]4=1×10—29,c(OH-)=10-6mol/L;c(H+)=10-8mol/L,pH=8;因此需调节pH为8以上;正确答案:c(Ce4+)[c(OH-)]4 ;8。
Ce4++4OH-,其溶度积表达式为Ksp=c(Ce4+)×[c(OH-)]4 ;为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,所以1×10-5×[c(OH-)]4=1×10—29,c(OH-)=10-6mol/L;c(H+)=10-8mol/L,pH=8;因此需调节pH为8以上;正确答案:c(Ce4+)[c(OH-)]4 ;8。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:![]() 。忽略固体体积,平衡时G的体积分数
。忽略固体体积,平衡时G的体积分数![]() 随温度和压强的变化如下表所示:
随温度和压强的变化如下表所示:
1.0 | 2.0 | 3.0 | |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | f | 83.0 |
下列判断不正确的是( )
A.该反应的![]()
B.K(1000℃)>K(810℃)
C.![]()
D.915℃,2.0MPa时E的转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价电子排布式为_______,基态氧原子的价层电子排布式不能表示为2s22px22py2,因为这违背了_______原理(规则)。
(2)[B(OH)4]-中硼原子的杂化轨道类型为______,氧原子的价层电子对互斥模型是_____。[Sn(OH)6] 2-中,Sn与O之间的化学键不可能是_____。
a.π键 b.σ键 c.配位键 d.极性键
(3)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式_______,并写出一种与氨硼烷互为等电子体的分子_______(填化学式)。
(4)已知硼酸(H3BO3)为一元弱酸,写出硼酸表现一元弱酸性的电离方程式________。
(5)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较高的是_______(填化学式),其原因是___________。
(6)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则2号砷原子的坐标为______。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______g·cm-3(列出含a、NA的计算式即可)。
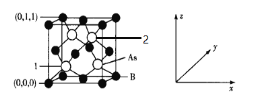
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.实验室用浓盐酸与MnO2制备氯气:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
D.过氧化钠与水反应:2Na2O2+2H2O=4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
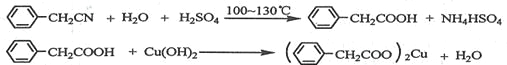
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
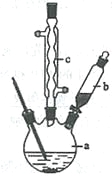
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是_____________________;仪器c的名称是______________,其作用是___________________________________________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是________________(填标号)。
A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是_____________,最终得到44 g纯品,则苯乙酸的产率是________。
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]() ,实验内容和结果分别如表和图所示,下列说法不正确的是( )
,实验内容和结果分别如表和图所示,下列说法不正确的是( )
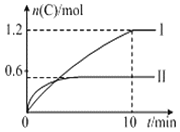
实验序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
I |
| 1mol | 3mol | 96kJ |
II |
|
|
| |
A.实验Ⅰ中,10min内平均速率![]()
![]()
B.上述方程式中![]()
C.![]() 时,该反应的平衡常数是
时,该反应的平衡常数是![]()
D.向实验Ⅱ的平衡体系中再充入![]() molA和
molA和![]() molB,A的转化率增大
molB,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二乙酸乙二酯可由X裂解得到的A和B合成。有关物质的转化关系如下:
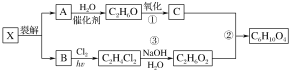
回答下列问题:
(1)B的结构简式为________。
(2)反应③的反应类型为________。
(3)C和C2H6O2反应的化学方程式为___________________________________。
(4)下列说法不正确的是________。
A.鉴别A和B也可以用溴水
B.C2H6O也可以分两步氧化成C
C.C2H2O2和C2H6O在浓硫酸作用下也可以加热生成C6H10O4
D.X一定是丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com