
【题目】已知Diels-Alder 反应的原理:![]() 。化合物Z可通过如下反应制备:
。化合物Z可通过如下反应制备:
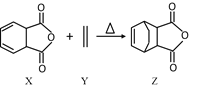
下列说法正确的是
A.化合物X中所有的碳原子共平面
B.化合物Z也可以用 ![]() 和
和 ![]() 来制备
来制备
C.1mol化合物Z可与3mol H2发生加成反应
D.化合物X的同分异构体中含有羧基的芳香族化合物有3种
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①___;
b.若B、C都不是气体,气体的平均相对分子质量②____;
c.若B是气体,C不是气体,气体的平均相对分子质量③___;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④___态,C是⑤___态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:3A(g)+2B(g) ![]() xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
A. x=3B. B的转化率为20%
C. 平衡时气体压强是原来的0.94倍D. 达到平衡时A的浓度为1.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代人追求“低碳生活” ,二氧化碳的回收并利用是环保领域研究的热点和重点。试分析并回答:
(1)有一最新美国科学家的研究成果,利用金属钛和某些装置等,模仿太阳的蓝色波长,使CO2慢慢发生人工“光合作用” 后,被还原成太阳能燃料——甲酸等,该化学方程式是_____________________________;
(2)另有一种用CO2生产甲醇燃料的方法:
CO2+3H2=CH3OH+H2O。已知298 K和101 kPa条件下:
CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ΔH=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热ΔH=________。
(3)工业上合成尿素的反应如下:
2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(l) ΔH<0,某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2∶1的物质的量之比充入一体积为10 L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20 min达到平衡,各物质浓度的变化曲线如图所示。
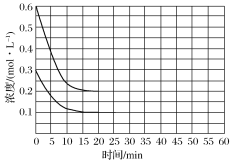
①为提高尿素的产率,下列可以采取的措施有________;
A.缩小反应容器的容积
B.升高温度
C.平衡体系中分离出部分CO(NH2)2
D.使用合适的催化剂
②若保持平衡的温度和压强不变,再向容器中充入3 mol的氨气,则此时v正________v逆(填“>”“=”或“<”),判断理由_____________________________;
③若保持平衡的温度和体积不变,25 min时再向容器中充入2 mol氨气和1 mol二氧化碳,在40 min时重新达到平衡,请在上图中画出25~50 min内氨气的浓度变化曲线________________。
(4)多孔Al2O3薄膜可作为催化剂载体、模板合成纳米材料等用途。现以高纯铝片作为阳极,不锈钢作为阴极,一定溶度的磷酸溶液作为电解质进行电解,即可初步制取多孔Al2O3膜。请写出该制取过程的阳极电极反应:__________________________________________。
(5)要实现CO2直接加H2合成汽油,关键是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法错误的是
(z) 互为同分异构体,下列说法错误的是
A.x的同分异构体只有y和z两种
B.z的二氯代物只有三种
C.x、y可使溴的四氯化碳溶液因发生加成反应而褪色
D.x、y、z中只有x的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.实验室用浓盐酸与MnO2制备氯气:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
D.过氧化钠与水反应:2Na2O2+2H2O=4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由Na+、Mg2+、Ba2+、Al3+、AlO2-、MnO![]() 、CO
、CO![]() 、SO
、SO![]() 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验:
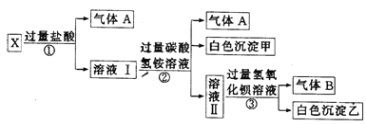
(1)气体A的成分是_______(填电子式),气体B的成分是_______(填结构式)
(2)X溶液中一定不存在的离子是______________。
(3)写出步骤①中发生反应的所有离子方程式:________________。
(4)写出步骤②中形成白色沉淀的离子方程式:________________。
(5)通过上述实验,溶液X中不能确定是否存在的离子是______________;只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用勒沙特列原理解释的是( )
A.500℃左右比室温更有利于合成氨的反应
B.低压有利于合成氨的反应
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.实验室常用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙![]() 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mol | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 |
| 2 | 4 |
| 8 |
乙 | 1 |
| 1 | 2 |
| 3 |
①T1℃时,该反应的平衡常数 ______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 ____![]() 填选项字母
填选项字母![]() .
.
A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入amolCO2(g)和bmolH2(g),反应达到平衡时,测得CO2的转化率大于![]() 的转化率,则
的转化率,则![]() 的值需满足的条件为 ______;
的值需满足的条件为 ______;
④丁容器的容积为1L,![]() 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______![]() 填选项字母
填选项字母![]() .
.
A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0mol、0mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示
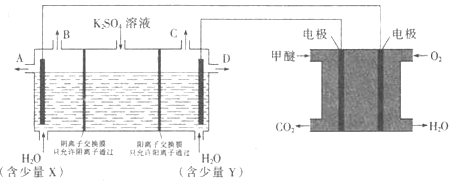
![]() 甲醚燃料电池的负极反应式为 ______
甲醚燃料电池的负极反应式为 ______
![]() 口导出的物质为 ______
口导出的物质为 ______![]() 填化学式
填化学式![]() .
.
![]() 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C口收集到标准状况下气体的体积为 ______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com