
将N2和H2以等物质的量充人一密闭容器中.在适当催化剂和恒温、恒压条件下反应。下列说法正确的是
A.达到化学平衡时,N2的正反应速率与H2逆反应速率相等
B.反应过程中,N2单质的体积分数始终为50%
C.达到化学平衡时,N2、H2在混合气体中的物质的量之比为1:1
D.达到化学平衡后,N2的正反应速率与NH3逆反应速率之比为2:1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.| 1 |
| 2 |
| 高温、高压 |
| 催化剂 |
| P |
| P0 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(16分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H22NH3 。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
查看答案和解析>>
科目:高中化学 来源:2012届山西省山大附中高三3月月考理综部分(带解析) 题型:填空题
(16分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2 2NH3。
2NH3。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三第五次月考化学试卷(解析版) 题型:填空题
(1)能源的开发利用与人类社会的可持续性发展息息相关。
已知:① Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H1=a kJ/mol
②CO(g)+1/2 O2(g)=CO2(g) △H2=b kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=c kJ/mol
则C的燃烧热____________________________kJ.mol-1
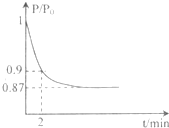
(2)某实验小组模拟工业合成氨反应N2+3H2 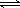 2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
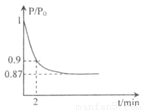
①反应达平衡的标志是(填字母代号)_____________
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为___________
③若提高N2的转化率可采取的措施有_______________
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中c(CO32-)=0.2mol/L,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol /L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com