
| A. | 该饱和溶液的物质的量浓度为5.07mol•L-1 | |
| B. | 向该溶液中加入等体积的水之后溶液的质量分数小于13.25% | |
| C. | 25℃时,密度等于1.12g•cm-3的NaCl溶液是饱和溶液 | |
| D. | 将此溶液蒸发掉部分水,再恢复到20℃时,溶液密度一定大于1.12g•cm-3 |
分析 A.物质的量浓度=$\frac{1000ρω}{M}$;
B.水的密度小于饱和氯化钠溶液的密度,则等体积的水质量小于饱和氯化钠溶液的质量;
C.NaCl的溶解度随着温度的升高而增大,当温度升高时,饱和氯化钠溶液的溶解度增大;
D.温度相同时,饱和氯化钠溶液的浓度不变.
解答 解:A.物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.12×26.5%}{58.5}$mol/L=5.07mol/L,故A正确;
B.水的密度小于饱和氯化钠溶液的密度,则等体积的水质量小于饱和氯化钠溶液的质量,所以向该溶液中加入等体积的水之后溶液的质量分数大于13.25%,故B错误;
C.NaCl的溶解度随着温度的升高而增大,当温度升高时,饱和氯化钠溶液的溶解度增大,所以25℃时,密度等于1.12g•cm-3的NaCl溶液不是饱和溶液,故C错误;
D.温度相同时,饱和氯化钠溶液的浓度不变,将此溶液蒸发掉部分水,再恢复到20℃时,会析出晶体,但溶液浓度不变,则溶液密度一定等于1.12g•cm-3,故D错误;
故选A.
点评 本题考查溶解度及其有关计算,为高频考点,侧重考查学生分析计算能力,明确溶解度含义及其影响因素是解本题关键,易错选项是D,注意:饱和溶液蒸发水分时会析出晶体但浓度不变,题目难度不大.


科目:高中化学 来源: 题型:解答题
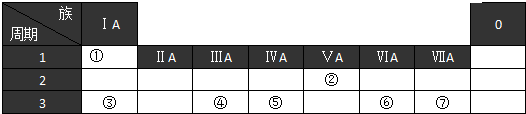
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一定条件下,1 mol A能与3 mol NaOH反应 | |
| B. | 一定条件下,1 mol A能和5 mol氢气发生加成反应 | |
| C. | 一定条件下和浓溴水反应时,1 mol A能消耗3 mol Br2 | |
| D. | A能与碳酸氢钠溶液反应并有气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
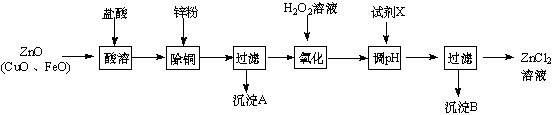
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
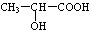 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
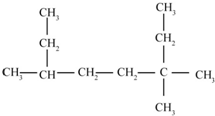 的名称为3,3,6-三甲基辛烷
的名称为3,3,6-三甲基辛烷 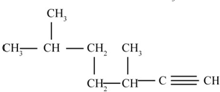 的名称为3,6-二甲基-1-庚炔
的名称为3,6-二甲基-1-庚炔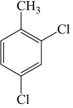 .
.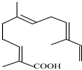 ,其分子式为C15H22O2.
,其分子式为C15H22O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com