
【题目】下列各组物质按照金属单质、混合物、氧化物的顺序排列的是 ( )
A. 水银、石灰石、过氧化氢 B. 氮气、空气、二氧化碳
C. 镁、海水、氧化钠 D. 铁、氢氧化钙、氧化铜
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如图所示。下列叙述错误的是
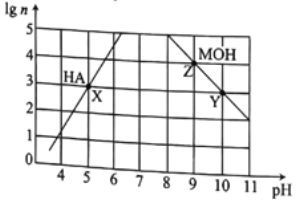
A. MOH为强碱,HA为弱酸
B. 水的电离程度:X=Y>Z
C. 若升高温度,Y、Z点对应溶液的pH值均减小
D. 将X点溶液与Z点溶液等体积混合,所得溶液中c(A-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是

A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为10-4.74 mol·L-1
C. 当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某容积一定的密闭容器中充入2molSO2和1molO2,一定条件下发生如下反应:2SO2+O2![]() 2SO3。下列说法不正确的是
2SO3。下列说法不正确的是
A. 升高温度或充入一定量O2均能加快化学反应速率
B. 达到平衡状态时,SO2、O2、SO3物质的量之比一定为2:1:2
C. 当SO2的生成速率与SO3的生成速率相等时,反应达到平衡状态
D. 达到平衡状态时,生成SO3的物质的量一定小于2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: . X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为 .
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号) .
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式) , 原因是 .
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式: .
(5)R的一种配合物的化学式为RCl36H2O.已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O
D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为: , 继续滴加氨水至过量,沉淀溶解, 得到天蓝色溶液,写反应的离子方程式为: .
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 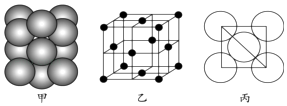
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为gcm﹣3(用字母表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是______(填“a”或“b”)电极。
②写出正极的电极反应式:_____________。
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) ![]() N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中![]() 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一.
(1)化学反应中有能量变化的本质原因是反应过程中有的断裂和形成.
(2)已知拆开1molH﹣H键、1molCl﹣Cl键、1molH﹣Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应 H2(g)+Cl2(g)=2HCl (g)的△H= .
(3)已知:CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJ/mol CH3OH(l)+
O2(g)═CO2(g)△H=﹣283.0kJ/mol CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(4)已知25℃、101kPa下,稀的强酸与稀的强碱溶液反应的中和热为﹣57.3kJ/mol. ①表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为;
②测定中和热实验中所需的玻璃仪器有烧杯、量筒、环形玻璃搅拌棒、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com