
【题目】肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是______(填“a”或“b”)电极。
②写出正极的电极反应式:_____________。
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) ![]() N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中![]() 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。

【答案】 ![]() N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534.4kJ/mol a O2+4e-+2H2O=4OH- 0.0125mol/(L·min)
N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534.4kJ/mol a O2+4e-+2H2O=4OH- 0.0125mol/(L·min)
【解析】(1)氨分子中氢原子被氨基(-NH2)取代后的生成物叫肼,分子中全部为单键;(2)正极是氧气得电子发生还原反应,负极肼失电子发生氧化反应;(3)在303K , Pt催化下,则发生N2H4(l) ![]() N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为2mol,此时N2H4(l)的物质的量为(0.1-x)mol ,根据4min 时比值为3,求出x的值,然后根
N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为2mol,此时N2H4(l)的物质的量为(0.1-x)mol ,根据4min 时比值为3,求出x的值,然后根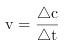 计算。
计算。
(1)由肼的球棍模型和价键理论可知,肼中氮氮原子之间、氮氢原子之间都是单键,所以肼的电子式为: ![]() 。答案:
。答案:![]() 。
。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。则1mol肼(N2H4)气体燃烧生成氮气和水蒸气,放出534.4kJ 的热量,所以肼反应的热化学方程式: N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534.4kJ/mol 。
(2)正极是氧气得电子发生还原反应,负极肼失电子发生氧化反应,所以a电极为电池的负极,因此,答案是:a。
(3)在303K、Pt催化下,则发生N2H4(l) ![]() N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为2mol,此时N2H4(l)的物质的量为(0.1-x)mol,根据4min时比值为3,所以3x/(0.1-x)=3,则x=0.05mol,
N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为2mol,此时N2H4(l)的物质的量为(0.1-x)mol,根据4min时比值为3,所以3x/(0.1-x)=3,则x=0.05mol,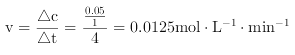 ,因此,本题正确答案是: 0.0125mol/(L·min)。
,因此,本题正确答案是: 0.0125mol/(L·min)。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】勒夏特列原理往往适用于化学学科中的各种平衡理论,请回答下列问题:
(1)氯水可以杀菌消毒。氯水中存在多个平衡,含氯元素的化学平衡有__________个。氯水处理饮用水时,在夏季的杀菌效果比在冬季差,可能的原因是__________(一种原因即可)。在氯水中,下列关系正确的是_________(选填编号)。
a.c(H+)=c(ClO-)+c(Cl-) b.c(Cl-)=c(ClO-)+c(HClO) c.c(HClO)<c(Cl-) d.c(Cl-)<c(ClO-)
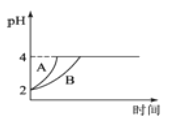
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则图中表示盐酸溶液中pH变化曲线的是__________(填“A”或“B”),反应开始时,产生H2的速率A__________B;加入足量Zn粒使酸均完全反应,产生H2的体积(相同状况下)A__________B(填“>”、“<”或“=”)
(3)难溶电解质在水溶液中存在溶解平衡,某MSO4溶液里c(M2+)=0.002mol·L-1,如果要将M2+完全转化成M(OH)2沉淀,应调整溶液pH的范围是______________[该温度下M(OH)2的Ksp=1×10-12,一般认为离子浓度≤1×10-5mol/L为完全沉淀]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为: C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
CO(g)+ ![]() O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
根据以上数据,写出C(s)与水蒸气反应生成CO(g)和H2(g)的热化学方程式: .
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键键能: P﹣P 198kJmol﹣1 , Cl﹣Cl 243kJmol﹣1 , P﹣Cl 331kJmol﹣1 .
则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热△H= . 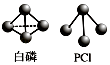
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按照金属单质、混合物、氧化物的顺序排列的是 ( )
A. 水银、石灰石、过氧化氢 B. 氮气、空气、二氧化碳
C. 镁、海水、氧化钠 D. 铁、氢氧化钙、氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
A.H2O与BeCl2为角形(V形)
B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形
D.SO3与CO ![]() 为平面三角形
为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]化合物M是合成香精的重要原料。实验室由A和芳香烃E制备M的一种合成路线如下:

已知:![]()
请回答下列问题:
(1)A的化学名称为___________,F的结构简式为______________。
(2)B中官能团的名称为______________。
(3)F→G的反应类型为__________________。
(4)D+G→M的化学方程式为_________________。
(5)写出同时满足下列条件的D的同分异构体的结构简式___________。
①能发生水解反应和银镜反应
②不含环状结构
③核磁共振氢谱有4组峰
(6)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线______________________。
的合成路线______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1.4gC2H4、C3H6的混合气体中,所含碳原子总数为0.lNA
B. 在0.1 mol·L Na2S溶液中,S2-、HS-、H2S微粒总数为0.1NA![]()
C. 标准状况下,22.4LC2H6中所含极性共价键的数目为7NA
D. 50mL l2mol·L的浓盐酸与足量MnO2反应,转移电子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。Z在短周期主族元素中原子半径最大;m、n、p、q为它们的单质;常温下,q为黄绿色气体,a为无色液体;各物质间转化关系如图所示。下列说法不正确的是
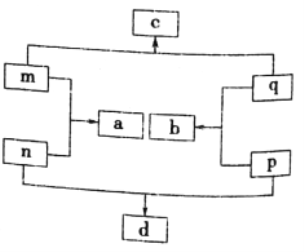
A. d中可能含有非极性共价键
B. Y、Z、W分别与X形成的化合物沸点:Z<Y<W
C. m在q中燃烧,产生大量白雾
D. 元素非金属性:Y>W>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com