
【题目】[化学-选修5:有机化学基础]化合物M是合成香精的重要原料。实验室由A和芳香烃E制备M的一种合成路线如下:

已知:![]()
请回答下列问题:
(1)A的化学名称为___________,F的结构简式为______________。
(2)B中官能团的名称为______________。
(3)F→G的反应类型为__________________。
(4)D+G→M的化学方程式为_________________。
(5)写出同时满足下列条件的D的同分异构体的结构简式___________。
①能发生水解反应和银镜反应
②不含环状结构
③核磁共振氢谱有4组峰
(6)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线______________________。
的合成路线______________________。
【答案】 2-丁醇 ![]() 碳基 水解反应(或取代反应)
碳基 水解反应(或取代反应) 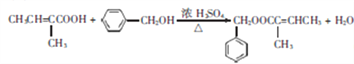
![]()
【解析】根据有机物D结构简式可知,有机物C发生消去反应生成有机物D,根据信息羰基与HCN在一定条件下发生加成反应、水解反应可知,有机物B为丁酮,有机物A 为2-丁醇,有机物M有12个碳,有机物D有5个碳,所以有机物G为含有7个碳芳香醇,有机物E和氯气发生取代反应生成芳香氯代烃F;
(1)由以上分析可知,A为2-丁醇;有机物E和氯气发生取代反应生成芳香氯代烃F,所以有机物F结构简式为![]() ;正确答案:2-丁醇 ;
;正确答案:2-丁醇 ; ![]() 。
。
(2) 有机物A 为2-丁醇发生催化氧化变为丁酮,所以有机物B中官能团为碳基;正确答案:羰基。
(3)有机物F为![]() ,在氢氧化钠的溶液中加热发生取代反应,生成醇;正确答案:水解反应(或取代反应)。
,在氢氧化钠的溶液中加热发生取代反应,生成醇;正确答案:水解反应(或取代反应)。
(4)有机物D为![]() ,有机物G为
,有机物G为![]() ,在浓硫酸加热条件下发生酯化反应,化学方程式为:
,在浓硫酸加热条件下发生酯化反应,化学方程式为: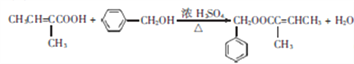 ;正确答案:
;正确答案: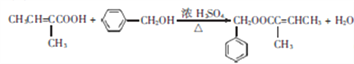 。
。
(5)有机物D为![]() ,其同分异构体满足:①能发生水解反应和银镜反应,一定含有HCOO-结构,②不含环状结构,为链状结构,含有碳碳双键;③核磁共振氢谱有4组峰,有4种不同的氢;满足此条件的有机物有2种:
,其同分异构体满足:①能发生水解反应和银镜反应,一定含有HCOO-结构,②不含环状结构,为链状结构,含有碳碳双键;③核磁共振氢谱有4组峰,有4种不同的氢;满足此条件的有机物有2种:![]() ;正确答案:
;正确答案:![]() 。
。
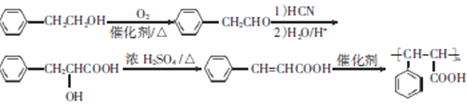
6)根据生成物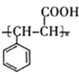 可知,合成该有机物需要发生加聚反应,其单体为
可知,合成该有机物需要发生加聚反应,其单体为![]() ;根据
;根据![]() 发生催化氧化变为
发生催化氧化变为![]() ,然后利用信息
,然后利用信息![]() 与HCN在一定条件下发生反应生成了
与HCN在一定条件下发生反应生成了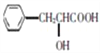 ,该有机物再发生消去反应生成了
,该有机物再发生消去反应生成了![]() ,该有机物再发生加聚反应生成
,该有机物再发生加聚反应生成 ;具体流程如下:
;具体流程如下: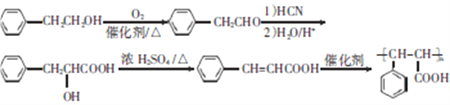 ;正确答案:
;正确答案:
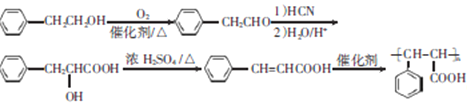 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在容积为0.4L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
(1)该反应的△H_______0(填“>”或“<”下同)。
(2)100℃时,体系中各物质浓度随时间变化如图所示。
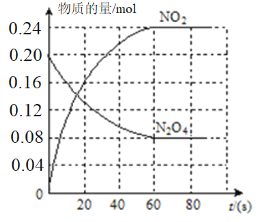
在0~60s时段,反应速率v(N2O4)为__________;反应的平衡常数K的值为_________。反应达平衡后,再向容器中充入0.4molN2O4。平衡向_________(填“正反应”或“逆反应”)方向移动,再次达到平衡时,N2O4的转化率与原平衡相比_________(填“变大”“变小”或“不变”)。
(3)100℃,相同容器中充入2.4molNO2与0.8molN2O4,则反应达平衡之前v正_____v逆。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某容积一定的密闭容器中充入2molSO2和1molO2,一定条件下发生如下反应:2SO2+O2![]() 2SO3。下列说法不正确的是
2SO3。下列说法不正确的是
A. 升高温度或充入一定量O2均能加快化学反应速率
B. 达到平衡状态时,SO2、O2、SO3物质的量之比一定为2:1:2
C. 当SO2的生成速率与SO3的生成速率相等时,反应达到平衡状态
D. 达到平衡状态时,生成SO3的物质的量一定小于2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是______(填“a”或“b”)电极。
②写出正极的电极反应式:_____________。
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) ![]() N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中![]() 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为01mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中,分别加入NaOH的稀溶液,lg![]() 随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )
随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )
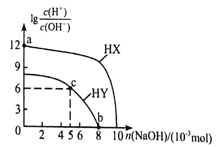
A. a点溶液的ph=2
B. 水的电离程度:a<b<c
C. b点溶液中:c(Yˉ)+c(HY)=c(Na+)
D. c点溶液中:c(Yˉ)>C(Na+)>c(HY)>c(H+)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一.
(1)化学反应中有能量变化的本质原因是反应过程中有的断裂和形成.
(2)已知拆开1molH﹣H键、1molCl﹣Cl键、1molH﹣Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应 H2(g)+Cl2(g)=2HCl (g)的△H= .
(3)已知:CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJ/mol CH3OH(l)+
O2(g)═CO2(g)△H=﹣283.0kJ/mol CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(4)已知25℃、101kPa下,稀的强酸与稀的强碱溶液反应的中和热为﹣57.3kJ/mol. ①表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为;
②测定中和热实验中所需的玻璃仪器有烧杯、量筒、环形玻璃搅拌棒、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝([Al2( OH)nCl6-n]m}是一种新型高效净水剂,与一般絮凝剂相比,它的吸附能力强、絮凝率高,可由AlCl3经水解法制得。回答下列问题:
(1)工业上可用Cl2、Al2O3和焦炭在高温下反应制取AlCl3![]()
已知:4Al(s)+3O2(g)=2Al2O3(s) △H1
2C(s)+O2(g)=2CO(g) △H2
2Al(s)+3Cl2(g)=2A1Cl3(g) △H3
①Al2O3(s)+3C(s)+3Cl2(g) ![]() 2AlCl3(g)+3CO(g) △H=____________________。
2AlCl3(g)+3CO(g) △H=____________________。
②反应3A12O3(s)+6Cl2(g) ![]() 4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是_________________________________。
4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是_________________________________。
(2)AlCl3在水溶液中分三步水解
Al3++H2O![]() Al(OH)2++H+ K1
Al(OH)2++H+ K1
Al(OH)2++H2O![]() Al(OH)2++H+ K2
Al(OH)2++H+ K2
Al(OH)2++ H2O![]() Al(OH)3+H+ K3
Al(OH)3+H+ K3
①K1、K2、K3由小到大的顺序是_______________________。
②控制溶液的pH在一定范围内,上述水解产物才能聚合生成聚合氯化铝。pH偏小时,Al3+的水解程度弱;pH偏大时的影响是___________________________。
(3)已知有如下可逆反应: ![]()
![]()
298K时,将1mL 1 mol·L-1 AlCl3溶液与1mL2 a mol ·L-1H2QSI溶液混合发生上述反应,溶液中c[Al(HQSI)2+]与时间(t)的关系如图所示。
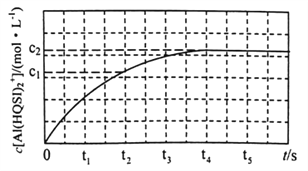
①下列可判断该反应达到平衡状态的是______________(填标号)。![]()
A.溶液的pH不再变化 B. v(Al3+)=v [Al(HQSI)2+]
C.溶液颜色不再变化 D.c(A13+)/c(H2QSI)不再变化
②0~t2时间内,该反应的平均反应速率v(H2QSI)= _________________。
③298K时,该反应的平衡常数K=_________________。
(4)该方法制得的聚合氯化铝的优点是不含其它金属离子,但盐基度低(盐基度:衡量絮凝剂絮凝效果的重要指标,定义式为:盐基度=n(OH)/3n(Al),n为物质的量)。常温下实验测量样品的盐基度,取m g样品,该样品中Al的质量分数为w;加入煮沸后冷却的蒸馏水溶解,配成1L溶液,测得该溶液pH=9.0。则其盐基度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一容积为10 L的恒容密闭容器中充入2 mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ/mol。当反应进行10分钟时达到平衡状态,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ/mol。当反应进行10分钟时达到平衡状态,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)SO2的转化率为______________________。
(2)从开始到10分钟,用氧气表示该反应的平均反应速率v(O2)=______________________。
(3)达到平衡时反应放出的热量为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com