
【题目】常温下,向浓度均为01mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中,分别加入NaOH的稀溶液,lg![]() 随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )
随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )
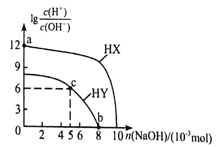
A. a点溶液的ph=2
B. 水的电离程度:a<b<c
C. b点溶液中:c(Yˉ)+c(HY)=c(Na+)
D. c点溶液中:c(Yˉ)>C(Na+)>c(HY)>c(H+)>c(OHˉ)
【答案】D
【解析】A.a点溶液lg![]() =12,结合c(H+)×c(OH-)=10-14,可知c(H+)=10-1 molL-1,ph=1,选项A错误;B、01mol·L-1的一元酸HY溶液lg
=12,结合c(H+)×c(OH-)=10-14,可知c(H+)=10-1 molL-1,ph=1,选项A错误;B、01mol·L-1的一元酸HY溶液lg![]() =9,c(H+)=10-2.5 molL-1,为弱酸,加入氢氧化钠至lg
=9,c(H+)=10-2.5 molL-1,为弱酸,加入氢氧化钠至lg![]() =0时碱的量不足,故c到b酸抑制水电离的程度减小,水的电离程度:a<c<b,选项B错误;C. b点溶液中lg
=0时碱的量不足,故c到b酸抑制水电离的程度减小,水的电离程度:a<c<b,选项B错误;C. b点溶液中lg![]() =0:电荷守恒有c(Yˉ)+c(OH-)=c(Na+)+ c(H+),故c(Yˉ) =c(Na+),选项C错误;D. c点为HY和NaY按1:1形成的溶液且呈酸性:c(Yˉ)>C(Na+)>c(HY)>c(H+)>c(OHˉ),选项D正确。答案选D。
=0:电荷守恒有c(Yˉ)+c(OH-)=c(Na+)+ c(H+),故c(Yˉ) =c(Na+),选项C错误;D. c点为HY和NaY按1:1形成的溶液且呈酸性:c(Yˉ)>C(Na+)>c(HY)>c(H+)>c(OHˉ),选项D正确。答案选D。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】下图中甲和乙均是盐桥原电池装置。请按要求填空
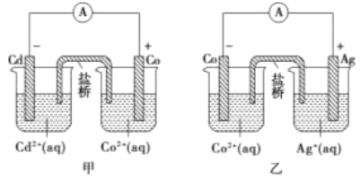
(1)甲中Co电极发生的反应方程式为_____________________________________。
(2)两烧杯中盐桥(填充物为浸有饱和KNO3溶液的琼脂)的作用是__________并使两烧杯中溶液保持电中性。
(3)判断反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能否自发进行并解释理由_________________________。
(4)开始时,乙电池左右烧杯各含100溶液,且Co2+、Ag+浓度均为4mol/L,当有1.204×1022个电子通过外电路时,两烧杯溶液中Co2+、Ag+浓度差为__________(忽略溶液的体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
A.H2O与BeCl2为角形(V形)
B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形
D.SO3与CO ![]() 为平面三角形
为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]化合物M是合成香精的重要原料。实验室由A和芳香烃E制备M的一种合成路线如下:

已知:![]()
请回答下列问题:
(1)A的化学名称为___________,F的结构简式为______________。
(2)B中官能团的名称为______________。
(3)F→G的反应类型为__________________。
(4)D+G→M的化学方程式为_________________。
(5)写出同时满足下列条件的D的同分异构体的结构简式___________。
①能发生水解反应和银镜反应
②不含环状结构
③核磁共振氢谱有4组峰
(6)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线______________________。
的合成路线______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+B=C+D的能量变化如图所示(E1、E2均为正值),下列说法正确的是

A. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
B. 该反应吸收的能最为(E1-E2)
C. A和B的总能量一定高于C和D的总能量
D. 该反应只有在加热条件下才能进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1.4gC2H4、C3H6的混合气体中,所含碳原子总数为0.lNA
B. 在0.1 mol·L Na2S溶液中,S2-、HS-、H2S微粒总数为0.1NA![]()
C. 标准状况下,22.4LC2H6中所含极性共价键的数目为7NA
D. 50mL l2mol·L的浓盐酸与足量MnO2反应,转移电子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,且能量变化如图所示的是( ) 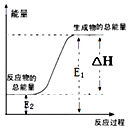
A.锌粒和稀硫酸反应
B.灼热的木炭与CO2反应
C.甲烷在空气中燃烧的反应
D.Ba(OH)28H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃.
(1)基态锌原子的价电子排布式是 .
(2)根据元素周期律,电负性SeS,第一电离能SeAs(填“>”或“<”).
(3)H2Se的分子构型是 , 其中Se的杂化轨道类型是 .
(4)H2O的沸点(填“>”或“<”)H2Se的沸点,其原因是: .
(5)晶体Zn为六方最密堆积,其配位数是 .
(6)在硒化锌ZnSe晶胞中,Se2﹣离子作面心立方最密堆积,且Se2﹣与Se2﹣之间的最短距离为a nm,则晶胞边长为 nm.
(7)假设阿伏伽德罗常数值为NA , 则144g 硒化锌ZnSe晶体中的晶胞数是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com