
【题目】勒夏特列原理往往适用于化学学科中的各种平衡理论,请回答下列问题:
(1)氯水可以杀菌消毒。氯水中存在多个平衡,含氯元素的化学平衡有__________个。氯水处理饮用水时,在夏季的杀菌效果比在冬季差,可能的原因是__________(一种原因即可)。在氯水中,下列关系正确的是_________(选填编号)。
a.c(H+)=c(ClO-)+c(Cl-) b.c(Cl-)=c(ClO-)+c(HClO) c.c(HClO)<c(Cl-) d.c(Cl-)<c(ClO-)
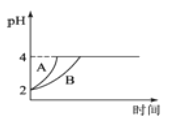
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则图中表示盐酸溶液中pH变化曲线的是__________(填“A”或“B”),反应开始时,产生H2的速率A__________B;加入足量Zn粒使酸均完全反应,产生H2的体积(相同状况下)A__________B(填“>”、“<”或“=”)
(3)难溶电解质在水溶液中存在溶解平衡,某MSO4溶液里c(M2+)=0.002mol·L-1,如果要将M2+完全转化成M(OH)2沉淀,应调整溶液pH的范围是______________[该温度下M(OH)2的Ksp=1×10-12,一般认为离子浓度≤1×10-5mol/L为完全沉淀]。
【答案】 3 温度较高时,HClO会分解或温度升高,氯气的溶解度减小 bc A = < ≥10.5
【解析】(1)氯气与水反应、HClO的电离及氯气的溶解均存在平衡;夏季温度高,HClO不稳定,光照分解;根据电荷守恒和物料守恒解答;
(2)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢,据此判断;
(3)根据溶度积常数计算。
(1)氯水中含氯元素的平衡关系为Cl2(aq)+H2O![]() HClO+H++Cl-、HClO
HClO+H++Cl-、HClO![]() H++ClO-、Cl2(g)
H++ClO-、Cl2(g)![]() Cl2(aq),即含氯元素的化学平衡有3个;夏季的杀菌效果比在冬季差,可能原因是夏季温度高,HClO易分解,杀菌效果比在冬季差;a.电荷守恒式为c(H+)=c(ClO-)+c(Cl-)+c(OH-),a错误;b.物料守恒为c(Cl-)=c(ClO-)+c(HClO),b正确;
Cl2(aq),即含氯元素的化学平衡有3个;夏季的杀菌效果比在冬季差,可能原因是夏季温度高,HClO易分解,杀菌效果比在冬季差;a.电荷守恒式为c(H+)=c(ClO-)+c(Cl-)+c(OH-),a错误;b.物料守恒为c(Cl-)=c(ClO-)+c(HClO),b正确;
c.由Cl2(aq)+H2O![]() HClO+H++Cl-、HClO
HClO+H++Cl-、HClO![]() H++ClO-可知,c(HClO)<c(Cl-),c正确;d.由Cl2(aq)+H2O
H++ClO-可知,c(HClO)<c(Cl-),c正确;d.由Cl2(aq)+H2O![]() HClO+H++Cl-、HClO
HClO+H++Cl-、HClO![]() H++ClO-可知,c(ClO-)<c(Cl-),d错误;答案选bc;
H++ClO-可知,c(ClO-)<c(Cl-),d错误;答案选bc;
(2)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,因此B曲线是醋酸溶液的pH变化曲线,则图中表示盐酸溶液中pH变化曲线的是A;反应开始时溶液中氢离子浓度相等,所以产生H2的速率A=B;由于醋酸的浓度大于盐酸的浓度,在溶液体积相等的条件下,加入足量Zn粒使酸均完全反应,醋酸产生H2多,即氢气的体积(相同状况下)A<B。
(3)离子浓度≤1×10-5mol/L为完全沉淀,则根据溶度积常数可知c(OH-)=![]() ,此时氢离子浓度是10-10.5mol/L,因此应调整溶液pH的范围是≥10.5。
,此时氢离子浓度是10-10.5mol/L,因此应调整溶液pH的范围是≥10.5。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】某化学小组以铁为阳极,探究不同条件下阳极发生的电极反应。
实验装置 | 实验 | 电压 | 电解液 | 实验现象 |
| ⅰ | 3V | 3mol/LNa2SO4溶液 | 碳棒表面有大量气泡产生,溶液变黄,有红褐色沉淀产生 |
ⅱ | 3V | 3 mol/L KI溶液 | 碳棒表面有大量气泡产生,铁丝附近溶液变为棕色,逐渐变为棕褐色,约5min后,棕褐色消失,逐渐产生灰绿色絮状物 | |
ⅲ | 3V | 3mol/L NaOH溶液 | 两电极上都有大量气泡产生,5min后停止实验,取出铁丝,铁丝明显受腐,附有红棕色固体,溶液中未见沉淀物。 |
(1)①实验ⅰ中碳棒表面产生的气体是__________。
②实验ⅲ中铁丝上生成气体的电极反应式为__________。
③在实验ⅱ中,为验证铁丝电极的产物,取少量铁丝附近棕色溶液于试管中,滴加2滴K3Fe(CN)6溶液,无明显变化;另取少量铁丝附近棕色溶液检验发现溶液中有I2,检验方法是__________;对比实验ⅰ、ⅱ、ⅲ,可得出的结论是__________。
(2)为进一步探究增大c(OH-)对阳极反应的影响,该小组利用原装置做了实验ⅳ。
实验 | 电压 | 电解液 | 实验现象 |
ⅳ | 3V | 10 mol/L NaOH溶液 | 两电极上都有大量气泡产生,但碳棒上的速率远大于铁丝,且阳极区溶液逐渐变紫红色;停止实验,铁丝明显变细,电解液仍然澄清 |
查阅资料:FeO42-在溶液中呈紫红色。阳极电极反应式是__________。
(3)为探究实验ⅰ中溶液变黄的原因,该小组利用原装置做了实验ⅴ和ⅵ。
实验 | 电压 | 电解液 | 实验现象 |
ⅴ | 3V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面有大量气泡产生,铁丝外围包裹一层白色絮状沉淀,2min后表层变为褐色。 |
ⅵ | 8V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面迅速产生大量气泡,铁丝表面有气泡,1min后外围包裹一层白色絮状沉淀,2min后变绿,溶液中有红褐色悬浮物。 |
①实验ⅵ中白色絮状沉淀变为红褐色的反应化学方程式是__________。
②由此确定实验ⅰ中溶液变黄的原因是__________。
(4)综合上述实验,当铁为阳极时,影响电解过程中的阳极电极产物的因素有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X2+的核外电子排布式为1s22s22p6,下列说法正确的是( )
A. X可能为稀有元素 B. X原子的核外电子排布为1s22s22p63s2
C. X原子的核外电子排布为1s22s22p62d2 D. X2+的最外电子层上有6个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
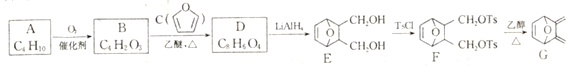
【题目】由化合物A 等为原料合成蒽环酮的中间体G 的合成路线如下:
已知以下信息:
①B 中含有五元环状结构; ![]() ;
;
②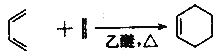 ;
;
③(CH3CO)2O或CH3COOC2H5![]() 2CH3CH2OH。
2CH3CH2OH。
回答下列问题:
(1)A的化学名称是____________________________。
(2)由B生成D和F生成G 的反应类型分别是_________________、____________________。
(3)D的结构简式为_____________________________。
(4)由E 生成F 的化学方程式为__________________________________。
(5)芳香化合物X是D 的同分异构体,X 分子中除苯环外不含其他环状结构,X 能与Na2CO3溶液反应,其核磁共振氢谱有4 组峰,峰面积之比为1:1:2 :2。写出1种符合要求的X 的结构简式:________________________________________________。
(6)写出以环戊烯(![]() ))和丙烯酸乙酯(
))和丙烯酸乙酯(![]() )为原料制备化合物
)为原料制备化合物![]() 的合成路线:_________________________________________________________(其他试剂任选)。
的合成路线:_________________________________________________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如图所示。下列叙述错误的是
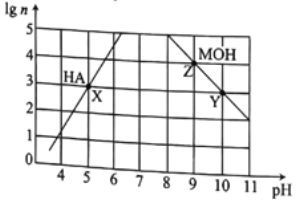
A. MOH为强碱,HA为弱酸
B. 水的电离程度:X=Y>Z
C. 若升高温度,Y、Z点对应溶液的pH值均减小
D. 将X点溶液与Z点溶液等体积混合,所得溶液中c(A-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从KNO3和少量NaCl杂质的混合物中提纯KNO3 . 涉及的操作依次有:①溶解、②过滤、③结晶、④冷却、⑤蒸发浓缩.其中合理的是( )
A.①②③④⑤
B.①③⑤④②
C.①⑤④③②
D.①②⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为0.4L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
(1)该反应的△H_______0(填“>”或“<”下同)。
(2)100℃时,体系中各物质浓度随时间变化如图所示。
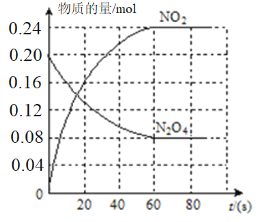
在0~60s时段,反应速率v(N2O4)为__________;反应的平衡常数K的值为_________。反应达平衡后,再向容器中充入0.4molN2O4。平衡向_________(填“正反应”或“逆反应”)方向移动,再次达到平衡时,N2O4的转化率与原平衡相比_________(填“变大”“变小”或“不变”)。
(3)100℃,相同容器中充入2.4molNO2与0.8molN2O4,则反应达平衡之前v正_____v逆。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体类型为 .
(2)①CH2=CH2、②CH≡CH、③ ![]() 、④CH3﹣CH3这四种分子中碳原子采取sp2杂化的是(填序号).
、④CH3﹣CH3这四种分子中碳原子采取sp2杂化的是(填序号).
(3)如图为某晶体的一个晶胞示意图,该晶体由A、B、C三种基本粒子组成,则该晶体的化学式为 . 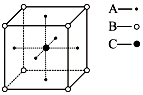
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是______(填“a”或“b”)电极。
②写出正极的电极反应式:_____________。
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) ![]() N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中![]() 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com