
【题目】某化学小组以铁为阳极,探究不同条件下阳极发生的电极反应。
实验装置 | 实验 | 电压 | 电解液 | 实验现象 |
| ⅰ | 3V | 3mol/LNa2SO4溶液 | 碳棒表面有大量气泡产生,溶液变黄,有红褐色沉淀产生 |
ⅱ | 3V | 3 mol/L KI溶液 | 碳棒表面有大量气泡产生,铁丝附近溶液变为棕色,逐渐变为棕褐色,约5min后,棕褐色消失,逐渐产生灰绿色絮状物 | |
ⅲ | 3V | 3mol/L NaOH溶液 | 两电极上都有大量气泡产生,5min后停止实验,取出铁丝,铁丝明显受腐,附有红棕色固体,溶液中未见沉淀物。 |
(1)①实验ⅰ中碳棒表面产生的气体是__________。
②实验ⅲ中铁丝上生成气体的电极反应式为__________。
③在实验ⅱ中,为验证铁丝电极的产物,取少量铁丝附近棕色溶液于试管中,滴加2滴K3Fe(CN)6溶液,无明显变化;另取少量铁丝附近棕色溶液检验发现溶液中有I2,检验方法是__________;对比实验ⅰ、ⅱ、ⅲ,可得出的结论是__________。
(2)为进一步探究增大c(OH-)对阳极反应的影响,该小组利用原装置做了实验ⅳ。
实验 | 电压 | 电解液 | 实验现象 |
ⅳ | 3V | 10 mol/L NaOH溶液 | 两电极上都有大量气泡产生,但碳棒上的速率远大于铁丝,且阳极区溶液逐渐变紫红色;停止实验,铁丝明显变细,电解液仍然澄清 |
查阅资料:FeO42-在溶液中呈紫红色。阳极电极反应式是__________。
(3)为探究实验ⅰ中溶液变黄的原因,该小组利用原装置做了实验ⅴ和ⅵ。
实验 | 电压 | 电解液 | 实验现象 |
ⅴ | 3V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面有大量气泡产生,铁丝外围包裹一层白色絮状沉淀,2min后表层变为褐色。 |
ⅵ | 8V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面迅速产生大量气泡,铁丝表面有气泡,1min后外围包裹一层白色絮状沉淀,2min后变绿,溶液中有红褐色悬浮物。 |
①实验ⅵ中白色絮状沉淀变为红褐色的反应化学方程式是__________。
②由此确定实验ⅰ中溶液变黄的原因是__________。
(4)综合上述实验,当铁为阳极时,影响电解过程中的阳极电极产物的因素有__________。
【答案】 H2 4OH--4e-=2H2O+O2↑或 2H2O-4e-=4H++O2↑ 取少量铁丝附近棕色溶液于试管中,滴加淀粉溶液,变为蓝色,说明该溶液含有I2 相同条件下,还原性I-强于Fe,先放电 Fe+8OH--6e-=FeO42-+4H2O 4Fe(OH)2+2H2O+O2=4Fe(OH)3 溶液中溶解的氧气将Fe2+氧化成了Fe3+ 电极材料、电解电压、电解液中阴离子的种类(还原性)及氢氧根浓度、溶解氧气等 (其他合理答案也可)
【解析】(1)①实验ⅰ中,铁为阳极,碳棒为阴极,阳极铁溶解,阴极上溶液中的氢离子放电生成氢气,故答案为:H2;
②实验ⅲ中铁为阳极,碳棒为阴极,阳极铁溶解,同时溶液中的氢氧根离子在阳极上放电生成氧气,生成气体的电极反应式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
③在实验ⅱ中,为验证铁丝电极的产物,取少量铁丝附近棕色溶液于试管中,滴加2滴K3Fe(CN)6溶液,无明显变化,说明没有生成亚铁离子;另取少量铁丝附近棕色溶液检验发现溶液中有I2,可以使用淀粉溶液检验;对比实验ⅰ、ⅱ、ⅲ可知,相同条件下,还原性I-强于Fe,先放电,故答案为:取少量铁丝附近棕色溶液于试管中,滴加淀粉溶液,变为蓝色,说明该溶液含有I2;相同条件下,还原性I-强于Fe,先放电;
(2)根据实验现象可知,阳极铁溶解生成了FeO42-,电极反应式为Fe+8OH--6e-=FeO42-+4H2O,故答案为:Fe+8OH--6e-=FeO42-+4H2O;
(3)①实验ⅵ中白色絮状沉淀为氢氧化亚铁,氢氧化亚铁容易被氧化生成红褐色的氢氧化铁,反应的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
②根据实验现象,阳极铁溶解后生成亚铁离子,溶液中溶解的氧气将Fe2+氧化成了Fe3+,使溶液变黄,故答案为:溶液中溶解的氧气将Fe2+氧化成了Fe3+;
(4)综合上述实验,当铁为阳极时,影响电解过程中的阳极电极产物的因素有电极材料、电解电压、电解液中阴离子的种类(还原性)及氢氧根浓度、溶解氧气等,故答案为:电极材料、电解电压、电解液中阴离子的种类(还原性)及氢氧根浓度、溶解氧气等。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为有机物,其中A 常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。已知醛基在氧气中易氧化成羧基,请回答下列问题:
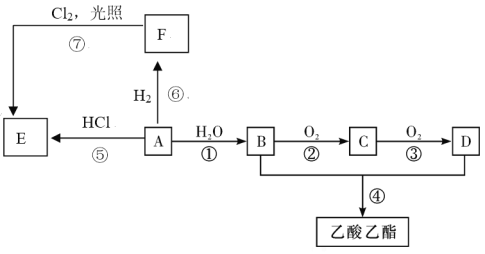
(1)A的分子式是_________,B中官能团的名称_____________。在反应①~④中,属于加成反应的是__________(填序号)。
(2)写出反应②的化学方程式:______________________________________________。
写出反应④的化学方程式:_________________________________________________。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吲哚昔酚 (idoxifene)可用于治疗骨质疏松症,它的合成路线如 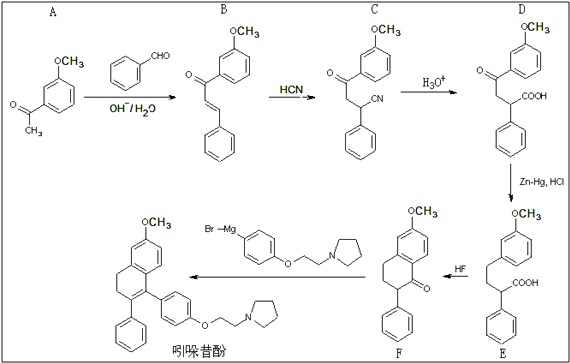
(1)反应类型:B→C;D→E
(2)D中的含氧官能团为(写名称)
(3)满足下列四个条件的A的同分异构体数目有种. ①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;③与FeCl3溶液作用不显色;④不与氢氧化钠水溶液反应
(4)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六元环,G结构简式为
(5)2,2﹣二甲基戊酸[CH3CH2CH2C(CH3)2COOH]是有机合成中间体,请设计合理的方案以丙酮(CH3COCH3)为唯一有机原料合成2,2﹣二甲基戊酸异丙酯(用合成路线流程图表示,并注明反应条件) 提示:①合成过程中无机试剂任选;②丙酮分子间能发生如图合成路线中A→B的类似反应;③合成路线流程图示例:CH3CH2OH ![]() CH2═CH2
CH2═CH2 ![]() CH2Br﹣CH2Br.
CH2Br﹣CH2Br.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | BaCO3 | MgO | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年俄罗斯世界杯官方比赛用球,新足球名为“Telstar 18(电视之星18)”,脱胎于1970年世界杯上经典的“电视之星 (Telstar)”。为了契合本次世界杯的环保主题,Telstar 18选用了具有较高环保性能的高科技材料——三元乙丙橡胶(EPDM)。化合物A![]() 是合成三元乙丙橡胶的重要中间体,可由B(C5H6)和C经Diels-Alder反应制得。已知最简单的Diels-Alder反应是
是合成三元乙丙橡胶的重要中间体,可由B(C5H6)和C经Diels-Alder反应制得。已知最简单的Diels-Alder反应是![]() ,完成下列填空。
,完成下列填空。
(1)写出由B和C合成A的化学方程式:________________,该反应属于________(填反应类型)。
(2)写出与 ![]() 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式:________________。分别写出生成这两种一溴代物所需要的反应试剂和反应条件①_______;②__________。
互为同分异构体,且一溴代物只有两种的芳香烃的结构简式:________________。分别写出生成这两种一溴代物所需要的反应试剂和反应条件①_______;②__________。
(3)已知:① CH3COONa+NaOH ![]() CH4↑+Na2CO3;
CH4↑+Na2CO3;
②
![]()
 ;
;
③ +CH3Br
+CH3Br![]()
![]() 。
。
利用所给信息,写出实验室由 制备
制备![]() 的合成路线。(合成路线常用的表示方式为:A
的合成路线。(合成路线常用的表示方式为:A ![]() B……
B……![]() 目标产物)__________。
目标产物)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0Lw mol·L-lCH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述正确的是
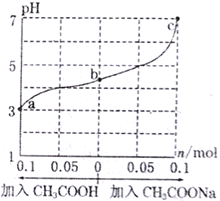
A. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
B. b点混合液中c(Na+)>c(CH3COO-)
C. 加入CH3COOH过程中,![]() 增大
增大
D. 25℃时,CH3COOH的电离平衡常数Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气的主要污染物之一,能形成酸雨、雾霾。大气中的氮氧化物主要来源于燃料的燃烧。
(1)已知:N2(g)+O2(g)![]() 2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
(2)T℃时,向1L恒容密闭容器中充入1molN2O3和1molO2,发生反应;N2O3(g)+O2(g)![]() N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
(3)用活化后的N2O5作催化剂,氨气可将NO和O2还原成N2和H2O。若参加反应的NH3和NO的物质的量相等,则该反应的化学方程式为___________。已知该反应的平衡常数与温度的关系为lg K=5.08+![]() 。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
(4)图I是用食盐水作电解液电解烟气脱氮的一种原理图,NO 被阳极产生的氧化性物质氧化为NO3-,尾气经氢氧化钠溶液吸收后再排入空气中。电流密度和溶液pH对烟气脱氮的影响如图II。
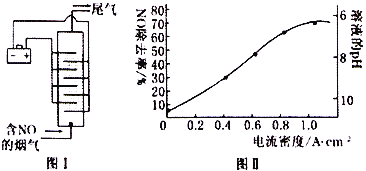
①处理后的尾气中,一定含有的气体单质是___________(填化学式)。
②溶液的pH对NO除去率有影响的原因是___________。
③若电极板面积为10cm2,实验烟气含NO的体积分数为1.5%,流速为0.070 L·s-1(气体体积已折算成标准状况,且烟气中无其他气体被氧化),测得电流密度为1.0A·cm-2。实验中NO除去率为___________(法拉第常数为96500C·mol-1))。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
(1)已知在常温常压下: ①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJmol﹣1
②H2O(l)═H2O(g)△H=+44.0kJmol﹣1
写出表示甲醇燃烧热的热化学方程式 .
(2)肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1mol N﹣H键所需的能量(kJ)是 . 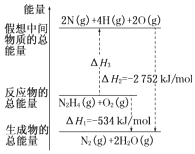
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】勒夏特列原理往往适用于化学学科中的各种平衡理论,请回答下列问题:
(1)氯水可以杀菌消毒。氯水中存在多个平衡,含氯元素的化学平衡有__________个。氯水处理饮用水时,在夏季的杀菌效果比在冬季差,可能的原因是__________(一种原因即可)。在氯水中,下列关系正确的是_________(选填编号)。
a.c(H+)=c(ClO-)+c(Cl-) b.c(Cl-)=c(ClO-)+c(HClO) c.c(HClO)<c(Cl-) d.c(Cl-)<c(ClO-)
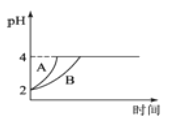
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则图中表示盐酸溶液中pH变化曲线的是__________(填“A”或“B”),反应开始时,产生H2的速率A__________B;加入足量Zn粒使酸均完全反应,产生H2的体积(相同状况下)A__________B(填“>”、“<”或“=”)
(3)难溶电解质在水溶液中存在溶解平衡,某MSO4溶液里c(M2+)=0.002mol·L-1,如果要将M2+完全转化成M(OH)2沉淀,应调整溶液pH的范围是______________[该温度下M(OH)2的Ksp=1×10-12,一般认为离子浓度≤1×10-5mol/L为完全沉淀]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com