
【题目】氮氧化物是大气的主要污染物之一,能形成酸雨、雾霾。大气中的氮氧化物主要来源于燃料的燃烧。
(1)已知:N2(g)+O2(g)![]() 2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
(2)T℃时,向1L恒容密闭容器中充入1molN2O3和1molO2,发生反应;N2O3(g)+O2(g)![]() N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
(3)用活化后的N2O5作催化剂,氨气可将NO和O2还原成N2和H2O。若参加反应的NH3和NO的物质的量相等,则该反应的化学方程式为___________。已知该反应的平衡常数与温度的关系为lg K=5.08+![]() 。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
(4)图I是用食盐水作电解液电解烟气脱氮的一种原理图,NO 被阳极产生的氧化性物质氧化为NO3-,尾气经氢氧化钠溶液吸收后再排入空气中。电流密度和溶液pH对烟气脱氮的影响如图II。
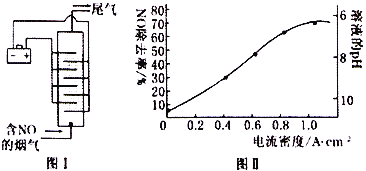
①处理后的尾气中,一定含有的气体单质是___________(填化学式)。
②溶液的pH对NO除去率有影响的原因是___________。
③若电极板面积为10cm2,实验烟气含NO的体积分数为1.5%,流速为0.070 L·s-1(气体体积已折算成标准状况,且烟气中无其他气体被氧化),测得电流密度为1.0A·cm-2。实验中NO除去率为___________(法拉第常数为96500C·mol-1))。
【答案】 810.25 2 4NH3+4NO+O2![]() 4N2+6H2O 逆向 增大 H2 次氯酸钠在酸性条件下氧化性增强 73.7%
4N2+6H2O 逆向 增大 H2 次氯酸钠在酸性条件下氧化性增强 73.7%
【解析】(1)已知:N2(g)+O2(g)![]() 2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,因为ΔH等于反应物的键能总和减去生成物的键能总和,所以,NO中N≡O键的键能为
2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,因为ΔH等于反应物的键能总和减去生成物的键能总和,所以,NO中N≡O键的键能为![]() 810.25 kJ·mol-1。
810.25 kJ·mol-1。
(2)T℃时,向1L恒容密闭容器中充入1molN2O3和1molO2,发生反应;N2O3(g)+O2(g)![]() N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则由N原子守恒可知,N2O3的转化率为50%,N2O3、O2、N2O5的平衡浓度均为0.5mol/L,则T℃时,该反应的平衡常数K=
N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则由N原子守恒可知,N2O3的转化率为50%,N2O3、O2、N2O5的平衡浓度均为0.5mol/L,则T℃时,该反应的平衡常数K=![]() 。
。
(3)用活化后的N2O5作催化剂,氨气可将NO和O2还原成N2和H2O。若参加反应的NH3和NO的物质的量相等,则该反应的化学方程式为4NH3+4NO+O2![]() 4N2+6H2O。已知该反应的平衡常数与温度的关系为lg K=5.08+
4N2+6H2O。已知该反应的平衡常数与温度的关系为lg K=5.08+![]() 。若该反应在t℃下达到平衡,升高温度时,K减小,平衡逆向移动,逆反应速率将增大。
。若该反应在t℃下达到平衡,升高温度时,K减小,平衡逆向移动,逆反应速率将增大。
(4)①由用食盐水作电解液电解烟气脱氮的原理可知,阴极上水电离的氢离子放电产生氢气,所以,处理后的尾气中,一定含有的气体单质是H2。
②由图可知,pH越小时NO的去除率越高,因为次氯酸钠在酸性条件下氧化性增强。
③若电极板面积为10cm2,实验烟气含NO的体积分数为1.5%,流速为0.070 L·s-1(气体体积已折算成标准状况,且烟气中无其他气体被氧化),测得电流密度为1.0A·cm-2。实验中NO除去率为![]() 73.7%。
73.7%。


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.Mg的摩尔质量是24g/mol
B.22gCO2物质的量为2.2mol
C.1molCl2中含有的氯原子数约为6.02×1023
D.常温常压下,1molN2的体积是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以铁为阳极,探究不同条件下阳极发生的电极反应。
实验装置 | 实验 | 电压 | 电解液 | 实验现象 |
| ⅰ | 3V | 3mol/LNa2SO4溶液 | 碳棒表面有大量气泡产生,溶液变黄,有红褐色沉淀产生 |
ⅱ | 3V | 3 mol/L KI溶液 | 碳棒表面有大量气泡产生,铁丝附近溶液变为棕色,逐渐变为棕褐色,约5min后,棕褐色消失,逐渐产生灰绿色絮状物 | |
ⅲ | 3V | 3mol/L NaOH溶液 | 两电极上都有大量气泡产生,5min后停止实验,取出铁丝,铁丝明显受腐,附有红棕色固体,溶液中未见沉淀物。 |
(1)①实验ⅰ中碳棒表面产生的气体是__________。
②实验ⅲ中铁丝上生成气体的电极反应式为__________。
③在实验ⅱ中,为验证铁丝电极的产物,取少量铁丝附近棕色溶液于试管中,滴加2滴K3Fe(CN)6溶液,无明显变化;另取少量铁丝附近棕色溶液检验发现溶液中有I2,检验方法是__________;对比实验ⅰ、ⅱ、ⅲ,可得出的结论是__________。
(2)为进一步探究增大c(OH-)对阳极反应的影响,该小组利用原装置做了实验ⅳ。
实验 | 电压 | 电解液 | 实验现象 |
ⅳ | 3V | 10 mol/L NaOH溶液 | 两电极上都有大量气泡产生,但碳棒上的速率远大于铁丝,且阳极区溶液逐渐变紫红色;停止实验,铁丝明显变细,电解液仍然澄清 |
查阅资料:FeO42-在溶液中呈紫红色。阳极电极反应式是__________。
(3)为探究实验ⅰ中溶液变黄的原因,该小组利用原装置做了实验ⅴ和ⅵ。
实验 | 电压 | 电解液 | 实验现象 |
ⅴ | 3V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面有大量气泡产生,铁丝外围包裹一层白色絮状沉淀,2min后表层变为褐色。 |
ⅵ | 8V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面迅速产生大量气泡,铁丝表面有气泡,1min后外围包裹一层白色絮状沉淀,2min后变绿,溶液中有红褐色悬浮物。 |
①实验ⅵ中白色絮状沉淀变为红褐色的反应化学方程式是__________。
②由此确定实验ⅰ中溶液变黄的原因是__________。
(4)综合上述实验,当铁为阳极时,影响电解过程中的阳极电极产物的因素有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜可用于彩色照相,是一种白色结晶状粉末,见光分解,在空气中会慢慢氧化成绿色,溶于氢溴酸、盐酸、硝酸和氨水,在热水中也会发生分解。实验室制备CuBr的装置示意图和步骤如下:
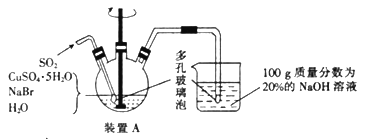
实验步骤:
①在装置A中加人50.0 g CuSO4o5H2O、30.9 g NaBr、150 mL蒸馏水,60℃时不断搅拌,以适当流速通入SO2;
②溶液冷却后倾去上层清液,在避光的条件下过滤;
③依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤;
④在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品21.6 g。
回答下列问题:
(1)步骤②中过滤需要避光的原因是________________________________________________。
(2)步骤①中实验所用蒸馏水事先要进行的处理操作是_______________,控制反应在60℃条件下进行,实验中可采取的措施是________________________。
(3)步骤③中洗涤剂需“溶有SO2”的原因是__________________________________;最后洗涤剂改用乙醚的目的是_____________________________________。
(4)装置A中反应生成CuBr的离子方程式为__________________________;说明反应已完成的现象是_____________________________________________________。
(5)本实验产品的产率是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1)Zn原子基态核外电子排布式为_____________________________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO42-互为等电子体的阴离子化学式为________________(写出一种)
②氨的热稳定性强于膦(PH3),原因是____________________________。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu< IZn的原因是___________________。
(4)《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。Zn、C、O电负性由大至小的顺序是_________________。ZnCO3中阴离子的立体构型是_____________________。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为________________。晶胞边长为apm,阿伏加德罗常数的值为NA,则ZnS晶体的密度为 __________g·cm-3(列出计算式即可)。
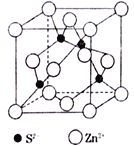
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬钙G是评价较好的解热、镇痛、消炎药,下面是它的一种合成路线(具体反应条件和部分试剂略)

已知①氯化亚砜(SOCl2)可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
② (X表示卤素原子)
(X表示卤素原子)
③R-X+NaCN![]() RCN+NaX
RCN+NaX
回答下列问题:
(1)写出D的结构简式:_______________。
(2)B→C的反应类型是___________;F中所含的官能团名称是_________。
(3)写出F和C在浓硫酸条件下反应的化学方程式_______________。
(4)A的同分异构体中符合以下条件的有______种(不考虑立体异构)
①属于苯的二取代物;②与FeCl3溶液发生显色反应。
其中核磁共振氢谱图中共有4个吸收峰的分子的结构简式为____________。
(5)结合上述推断及所学知识,参照上述合成路线任选无机试剂设计合理的方案,以苯甲醇(![]() )为原料合成苯乙酸苯甲酯(
)为原料合成苯乙酸苯甲酯(![]() )写出合成路线__________,并注明反应条件。
)写出合成路线__________,并注明反应条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X2+的核外电子排布式为1s22s22p6,下列说法正确的是( )
A. X可能为稀有元素 B. X原子的核外电子排布为1s22s22p63s2
C. X原子的核外电子排布为1s22s22p62d2 D. X2+的最外电子层上有6个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为0.4L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
(1)该反应的△H_______0(填“>”或“<”下同)。
(2)100℃时,体系中各物质浓度随时间变化如图所示。
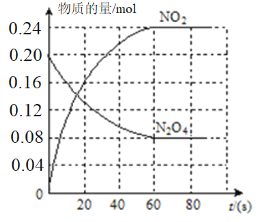
在0~60s时段,反应速率v(N2O4)为__________;反应的平衡常数K的值为_________。反应达平衡后,再向容器中充入0.4molN2O4。平衡向_________(填“正反应”或“逆反应”)方向移动,再次达到平衡时,N2O4的转化率与原平衡相比_________(填“变大”“变小”或“不变”)。
(3)100℃,相同容器中充入2.4molNO2与0.8molN2O4,则反应达平衡之前v正_____v逆。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com