
【题目】在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000molL﹣1的醋酸溶液中逐滴加入0.1000molL﹣1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( ) 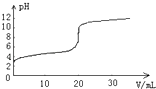
A.在反应过程中始终,c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣)
B.pH=4时,c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
C.pH=6时,c(CH3COO﹣)+c(CH3COOH)=0.1000 molL﹣1
D.pH=7时,消耗NaOH溶液的体积小于20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置能完成相应实验的是( ) 
A.装置①测定化学反应速率
B.装置②制取并吸收HCl
C.装置③量取8.5mL的稀硫酸
D.装置④模拟铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吲哚昔酚 (idoxifene)可用于治疗骨质疏松症,它的合成路线如 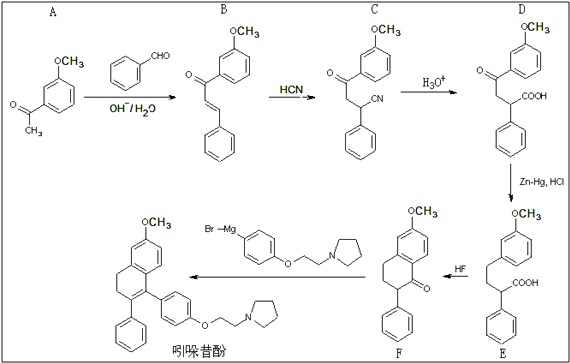
(1)反应类型:B→C;D→E
(2)D中的含氧官能团为(写名称)
(3)满足下列四个条件的A的同分异构体数目有种. ①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;③与FeCl3溶液作用不显色;④不与氢氧化钠水溶液反应
(4)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六元环,G结构简式为
(5)2,2﹣二甲基戊酸[CH3CH2CH2C(CH3)2COOH]是有机合成中间体,请设计合理的方案以丙酮(CH3COCH3)为唯一有机原料合成2,2﹣二甲基戊酸异丙酯(用合成路线流程图表示,并注明反应条件) 提示:①合成过程中无机试剂任选;②丙酮分子间能发生如图合成路线中A→B的类似反应;③合成路线流程图示例:CH3CH2OH ![]() CH2═CH2
CH2═CH2 ![]() CH2Br﹣CH2Br.
CH2Br﹣CH2Br.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是
A. 操作①和③中的有机相从分液漏斗上端倒出
B. 操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42-
C. 操作④为过滤
D. 操作⑤可用如图所示的水浴装置进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | BaCO3 | MgO | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年俄罗斯世界杯官方比赛用球,新足球名为“Telstar 18(电视之星18)”,脱胎于1970年世界杯上经典的“电视之星 (Telstar)”。为了契合本次世界杯的环保主题,Telstar 18选用了具有较高环保性能的高科技材料——三元乙丙橡胶(EPDM)。化合物A![]() 是合成三元乙丙橡胶的重要中间体,可由B(C5H6)和C经Diels-Alder反应制得。已知最简单的Diels-Alder反应是
是合成三元乙丙橡胶的重要中间体,可由B(C5H6)和C经Diels-Alder反应制得。已知最简单的Diels-Alder反应是![]() ,完成下列填空。
,完成下列填空。
(1)写出由B和C合成A的化学方程式:________________,该反应属于________(填反应类型)。
(2)写出与 ![]() 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式:________________。分别写出生成这两种一溴代物所需要的反应试剂和反应条件①_______;②__________。
互为同分异构体,且一溴代物只有两种的芳香烃的结构简式:________________。分别写出生成这两种一溴代物所需要的反应试剂和反应条件①_______;②__________。
(3)已知:① CH3COONa+NaOH ![]() CH4↑+Na2CO3;
CH4↑+Na2CO3;
②
![]()
 ;
;
③ +CH3Br
+CH3Br![]()
![]() 。
。
利用所给信息,写出实验室由 制备
制备![]() 的合成路线。(合成路线常用的表示方式为:A
的合成路线。(合成路线常用的表示方式为:A ![]() B……
B……![]() 目标产物)__________。
目标产物)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气的主要污染物之一,能形成酸雨、雾霾。大气中的氮氧化物主要来源于燃料的燃烧。
(1)已知:N2(g)+O2(g)![]() 2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
(2)T℃时,向1L恒容密闭容器中充入1molN2O3和1molO2,发生反应;N2O3(g)+O2(g)![]() N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
(3)用活化后的N2O5作催化剂,氨气可将NO和O2还原成N2和H2O。若参加反应的NH3和NO的物质的量相等,则该反应的化学方程式为___________。已知该反应的平衡常数与温度的关系为lg K=5.08+![]() 。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
(4)图I是用食盐水作电解液电解烟气脱氮的一种原理图,NO 被阳极产生的氧化性物质氧化为NO3-,尾气经氢氧化钠溶液吸收后再排入空气中。电流密度和溶液pH对烟气脱氮的影响如图II。
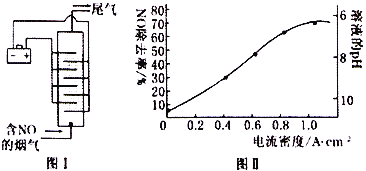
①处理后的尾气中,一定含有的气体单质是___________(填化学式)。
②溶液的pH对NO除去率有影响的原因是___________。
③若电极板面积为10cm2,实验烟气含NO的体积分数为1.5%,流速为0.070 L·s-1(气体体积已折算成标准状况,且烟气中无其他气体被氧化),测得电流密度为1.0A·cm-2。实验中NO除去率为___________(法拉第常数为96500C·mol-1))。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com