
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是
A. 操作①和③中的有机相从分液漏斗上端倒出
B. 操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42-
C. 操作④为过滤
D. 操作⑤可用如图所示的水浴装置进行
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。已知,能量密度=电池输出电能/燃料质量,以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
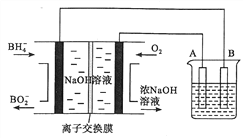
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=B![]() +6H2O
+6H2O
C. 若NaBH4 燃料电池的电压为U伏,则此电池的能量密度为2.03×104UkJ·kg-1
D. 每消耗2.24 L O2(标准状况)时,A电极的质量减轻12.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为__ __。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是_________ ___。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) =2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45 mol·L-1·s-1、②v(B)=0.6 mol·L-1·s-1、③v(C)=0.4 mol·L-1·s-1、④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④
C. ②>①=④>③ D. ①>④>②=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是
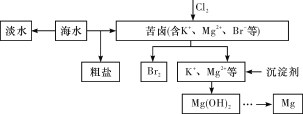
A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B. 将氯气通入苦卤中发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2
C. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂
D. 某同学设计了如下装置制取无水MgCl2,装置A的作用是制取干燥的HCl气体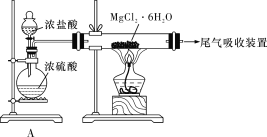
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关描述中正确的是( )
A.牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀
B.AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同
C.室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜可用于彩色照相,是一种白色结晶状粉末,见光分解,在空气中会慢慢氧化成绿色,溶于氢溴酸、盐酸、硝酸和氨水,在热水中也会发生分解。实验室制备CuBr的装置示意图和步骤如下:
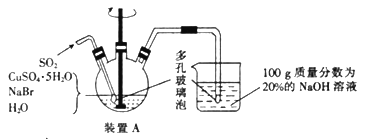
实验步骤:
①在装置A中加人50.0 g CuSO4o5H2O、30.9 g NaBr、150 mL蒸馏水,60℃时不断搅拌,以适当流速通入SO2;
②溶液冷却后倾去上层清液,在避光的条件下过滤;
③依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤;
④在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品21.6 g。
回答下列问题:
(1)步骤②中过滤需要避光的原因是________________________________________________。
(2)步骤①中实验所用蒸馏水事先要进行的处理操作是_______________,控制反应在60℃条件下进行,实验中可采取的措施是________________________。
(3)步骤③中洗涤剂需“溶有SO2”的原因是__________________________________;最后洗涤剂改用乙醚的目的是_____________________________________。
(4)装置A中反应生成CuBr的离子方程式为__________________________;说明反应已完成的现象是_____________________________________________________。
(5)本实验产品的产率是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )
A. 该元素原子中共有25个电子
B. 该元素原子核外有4个能层
C. 该元素原子最外层共有2个电子
D. 该元素原子M电子层共有8个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com