
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是
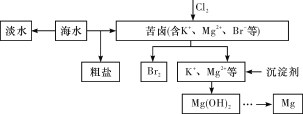
A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B. 将氯气通入苦卤中发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2
C. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂
D. 某同学设计了如下装置制取无水MgCl2,装置A的作用是制取干燥的HCl气体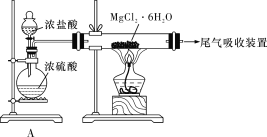
【答案】C
【解析】A.蒸馏法、电渗析法、离子交换法都可用于淡化海水,据此分析判断;B. 根据苦卤中主要含有溴的化合物分析判断;C. 根据氢氧化钠和氢氧化钙的工业成本分析判断;D.根据氯化镁加热时能够水解分析判断。
A.蒸馏法是把水从水的混合物中分离出来,得到纯净的水,通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的,利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果,故A正确;B. 苦卤中主要含有溴的化合物,将氯气通入苦卤中发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2,故B正确;C. 在工业上一般选用氢氧化钙作为沉淀剂,氢氧化钙可以通过加热分解石灰石或贝壳得到,成本较低,故C错误;D. 氯化镁加热时能够水解,生成的氯化氢易挥发,会促进水解,因此用如图装置制取无水MgCl2,需要在干燥的HCl气体的气氛中进行,故D正确;故选C。


科目:高中化学 来源: 题型:
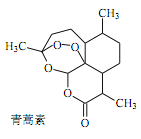
【题目】格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料(![]() )的合成路线。
)的合成路线。

(1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。
(2)写出下列物质的结构简式: E____ , F____。
(3)写出苯 → C的化学方程式:____
(4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。
(5)设计原料(![]() )合成产物(
)合成产物( )的合成路线:____
)的合成路线:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中医典籍《肘后备急方》所载治疗疟疾的方法“青蒿一握,以水二升渍,绞取汁,尽服之”, 对屠呦呦团队研发治疗疟疾的特效药——青蒿素有巨大的启示作用。屠呦呦在对比实验中发现古法疗效低下,她设计的提取青蒿素的工艺可以简化成如下流程:
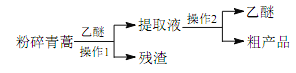
根据上述信息分析,下列判断或叙述中肯定错误的是
A. 从天然植物中提取有效成分治疗疾病是药物研发的重要途径
B. 将青蒿粉碎可以提高有效成分的提取率
C. 青蒿素易溶于水和乙醚
D. 操作 1 是过滤,操作 2 是蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为下图所示,这种有机物不可能具有的性质是( ) ①可以燃烧;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应.
A.①④
B.只有⑥
C.只有⑤
D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是
A. 操作①和③中的有机相从分液漏斗上端倒出
B. 操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42-
C. 操作④为过滤
D. 操作⑤可用如图所示的水浴装置进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据物质在生产、生活等方面的应用填空。
(1)厨房里常使用小苏打,向其水溶液中滴加酚酞溶液后,溶液呈__________(填字母代号)。
a.浅蓝色 b.浅红色 c.浅绿色
(2)检验某补铁剂中的Fe2+是否被氧化成Fe3+,可用__________溶液(填字母代号)。
a.NaOH b.H2O2 c.KSCN
(3)电解氧化铝时加入冰晶石的作用为________________。
(4)完成乙醇发生催化氧化的化学方程式:2CH3CH2OH+O2![]() _________________________。
_________________________。
(5)常见的酸性锌锰电池的负极材料为Zn,请写出负极的电极反应式:___________________。
(6)铝热反应是工业上常用的反应之一,请写出Al与Fe3O4发生铝热反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的单质及其作合物用途非常广泛。回答下列问题:
(1)某热电池放电时总反应为4Li+FeS2==Fe+2Li2S。该电池的正、负极材料分别是_______、____。
(2)Na2FeO4是一种优良的水处理剂。
①Na2FeO4可将水体中NH3转化为N2而除去同时产生红褐色沉淀,1mol Na2FeO4最多可脱除NH3的物质的量为______________________。
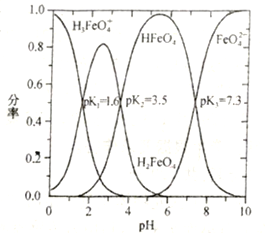
②Na2FeO4溶于水,溶液中含六价铁的微粒分率(某六价铁微粒数与所有六价铁微粒总数之比)与溶液pH关系如下图所示(已知常温下,H3FeO4+![]() H++H2FeO4,H2FeO4
H++H2FeO4,H2FeO4![]() H++HFeO4-,HFeO4-
H++HFeO4-,HFeO4-![]() H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O
H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O![]() HFeO4-+OH-的pK=______。
HFeO4-+OH-的pK=______。
(3)CO还原铁的氧化物时,涉及以下反应:
a.Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H1
3Fe(s)+4CO2(g)△H1
b.FeO(g)+CO(g) ![]() Fe(s)+CO2(g)△H2
Fe(s)+CO2(g)△H2
c.3Fe2O3(s)+CO(g) ![]() 2 Fe3O4 (s)+CO2(g)△H3
2 Fe3O4 (s)+CO2(g)△H3
d. Fe3O4 (s)+CO(g) ![]() 3FeO(s)+CO2(g)△H4
3FeO(s)+CO2(g)△H4
相关反应的温度与混合气体中CO的体积分数的关系如下图所示:
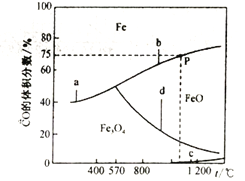
①反应的△H>0的是__________(选填a、b、c、d);△H4 =_______(用△H1、△H2表示)。
②在恒容密闭容器中,加入7.2gFeO,同时充入0.1molCO,升高温度,若恰好处于图中P点处,CO的转化率为_______,容器中生成单质Fe的质量为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com