
【题目】某有机物的结构为下图所示,这种有机物不可能具有的性质是( ) ①可以燃烧;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应.
A.①④
B.只有⑥
C.只有⑤
D.④⑥
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】科学家研制出合成药物W对肝癌的治疗,具有很好的效果。其由有机物A合成药物W的合成路线如下:
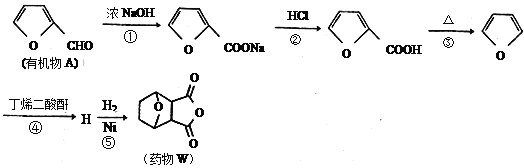
已知:①2HCHO+NaOH→CH3OH+HCOONa
②![]() (Diels-Aider反应)
(Diels-Aider反应)
③丁烯二酸酐结构简式为![]()
④当每个1,3-丁二烯分子与一分子氯气发生加成反应时,有两种产物:
CH2ClCH=CHCH2Cl;CH2ClCHClCH=CH2。
请回答下列问题:
(1)物质A中的含氧官能团名称为_______;第①步反应中除生成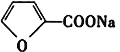 外,还生成另一产物,此产物的结构简式为__________________。
外,还生成另一产物,此产物的结构简式为__________________。
(2)写出H的结构简式_____________;第⑤步反应的反应类型是____________。
(3)药物W与N互为同分异构体。
①能与FeCl3溶液发生显色反应 ②能与Na2CO3溶液反应生成气体
③1mol N能与3mol NaOH完全反应
写出满足上述条件且其核磁共振氢谱有4个吸收峰的N的一种结构简式(不考虑立体异构)_____________________。
(4)下面是合成X的路线图:
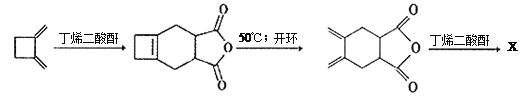
则X的结构简式为___________________。
(5)结合题中有关信息,写出由![]() 制备丁烯二酸酐
制备丁烯二酸酐![]() 的合成路线流程图______________(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图______________(无机试剂任选)。合成路线流程图示例如下:
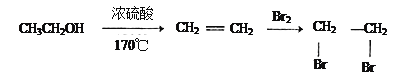 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为__ __。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是_________ ___。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与12C是同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) =2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45 mol·L-1·s-1、②v(B)=0.6 mol·L-1·s-1、③v(C)=0.4 mol·L-1·s-1、④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④
C. ②>①=④>③ D. ①>④>②=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是
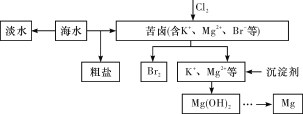
A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B. 将氯气通入苦卤中发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2
C. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂
D. 某同学设计了如下装置制取无水MgCl2,装置A的作用是制取干燥的HCl气体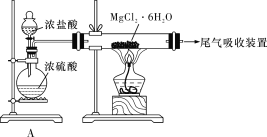
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关描述中正确的是( )
A.牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀
B.AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同
C.室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。
已知:Na2S、Na2CO3、Na2SO3、NaHCO3溶液呈碱性;NaHSO3溶液呈酸性。
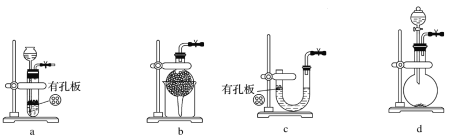
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填字母代号)。
(2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为_____________________________________;
②当浅黄色沉淀不再增多时,反应体系中有无色无味的气体产生,反应的化学方程式为________________________________;
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入过量的SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为________________________。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com