
ЁОЬтФПЁПЬњЕФЕЅжЪМАЦфзїКЯЮягУЭОЗЧГЃЙуЗКЁЃЛиД№ЯТСаЮЪЬт:
ЃЈ1ЃЉФГШШЕчГиЗХЕчЪБзмЗДгІЮЊ4Li+FeS2==Fe+2Li2SЁЃИУЕчГиЕФе§ЁЂИКМЋВФСЯЗжБ№ЪЧ_______ЁЂ____ЁЃ
ЃЈ2ЃЉNa2FeO4ЪЧвЛжжгХСМЕФЫЎДІРэМСЁЃ
ЂйNa2FeO4ПЩНЋЫЎЬхжаNH3зЊЛЏЮЊN2ЖјГ§ШЅЭЌЪБВњЩњКьКжЩЋГСЕэЃЌ1mol Na2FeO4зюЖрПЩЭбГ§NH3ЕФЮяжЪЕФСПЮЊ______________________ЁЃ
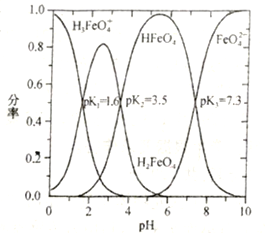
ЂкNa2FeO4ШмгкЫЎЃЌШмвКжаКЌСљМлЬњЕФЮЂСЃЗжТЪ(ФГСљМлЬњЮЂСЃЪ§гыЫљгаСљМлЬњЮЂСЃзмЪ§жЎБШ)гыШмвКpHЙиЯЕШчЯТЭМЫљЪО(вбжЊГЃЮТЯТЃЌH3FeO4+![]() H++H2FeO4ЃЌH2FeO4
H++H2FeO4ЃЌH2FeO4![]() H++HFeO4-ЃЌHFeO4-
H++HFeO4-ЃЌHFeO4-![]() H++FeO42-ЕФЕчРыГЃЪ§вРДЮЮЊK1ЁЂK2ЁЂK3ЃЛpK=-lgK)ЁЃpH=3ЪБЃЌШмвКжажївЊКЌЬњЮЂСЃХЈЖШДгДѓЕНЕФаЁЕФЫГађЮЊ________________ЃЛЗДгІFeO42-+H2O
H++FeO42-ЕФЕчРыГЃЪ§вРДЮЮЊK1ЁЂK2ЁЂK3ЃЛpK=-lgK)ЁЃpH=3ЪБЃЌШмвКжажївЊКЌЬњЮЂСЃХЈЖШДгДѓЕНЕФаЁЕФЫГађЮЊ________________ЃЛЗДгІFeO42-+H2O![]() HFeO4-+OH-ЕФpK=______ЁЃ
HFeO4-+OH-ЕФpK=______ЁЃ
ЃЈ3ЃЉCOЛЙдЬњЕФбѕЛЏЮяЪБЃЌЩцМАвдЯТЗДгІ:
a.Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)ЁїH1
3Fe(s)+4CO2(g)ЁїH1
b.FeO(g)+CO(g) ![]() Fe(s)+CO2(g)ЁїH2
Fe(s)+CO2(g)ЁїH2
c.3Fe2O3(s)+CO(g) ![]() 2 Fe3O4 (s)+CO2(g)ЁїH3
2 Fe3O4 (s)+CO2(g)ЁїH3
d. Fe3O4 (s)+CO(g) ![]() 3FeO(s)+CO2(g)ЁїH4
3FeO(s)+CO2(g)ЁїH4
ЯрЙиЗДгІЕФЮТЖШгыЛьКЯЦјЬхжаCOЕФЬхЛ§ЗжЪ§ЕФЙиЯЕШчЯТЭМЫљЪО:
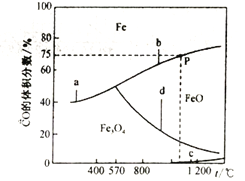
ЂйЗДгІЕФЁїH>0ЕФЪЧ__________(бЁЬюaЁЂbЁЂcЁЂd)ЃЛЁїH4 =_______(гУЁїH1ЁЂЁїH2БэЪО)ЁЃ
ЂкдкКуШнУмБеШнЦїжаЃЌМгШы7.2gFeOЃЌЭЌЪБГфШы0.1molCOЃЌЩ§ИпЮТЖШЃЌШєЧЁКУДІгкЭМжаPЕуДІЃЌCOЕФзЊЛЏТЪЮЊ_______ЃЌШнЦїжаЩњГЩЕЅжЪFeЕФжЪСПЮЊ___________________ЁЃ
ЁОД№АИЁП FeS2 Li 1mol H2FeO4ЁЂHFeO4-ЁЂH3FeO4+ 6.7 d ЁїH1-3ЁїH2 25% 1.4g
ЁОНтЮіЁПЃЈ1ЃЉе§МЋЗЂЩњЛЙдЗДгІЃЌFeS2ЛёЕУЕчзгЩњГЩFeЁЂS2ЃЌИКМЋЗЂЩњбѕЛЏЗДгІЃЌLiЪЇЕчзгЩњГЩLi+ЃЌвђДЫИУЕчГиЕФе§ЁЂИКМЋВФСЯЗжБ№ЪЧFeS2 КЭ LiЁЃД№АИЮЊ; FeS2 ЁЂ Li
ЃЈ2ЃЉЂйNa2FeO4НЋNH3зЊЛЏЮЊN2ЭЌЪББОЩэБЛЛЙдЮЊFe3+ЃЌИљОнЕУЪЇЕчзгЪ§ЪиКуПЩЕУ1mol Na2FeO4зюЖрПЩЭбГ§NH3ЕФЮяжЪЕФСПЮЊЃК![]() =1molЁЃЂкгЩЭМЯёПЩжЊpH=3ЪБЃЌШмвКжажївЊКЌЬњЮЂСЃХЈЖШзюДѓЕФЪЧH2FeO4ЃЌзюаЁЕФЪЧH3FeO4+ЃЌДІгкжаМфЕФЪЧHFeO4-ЃЌЫљвдШмвКжажївЊКЌЬњЮЂСЃХЈЖШДгДѓЕНЕФаЁЕФЫГађЮЊH2FeO4ЁЂHFeO4-ЁЂH3FeO4+ЃЛFeO42-+H2O
=1molЁЃЂкгЩЭМЯёПЩжЊpH=3ЪБЃЌШмвКжажївЊКЌЬњЮЂСЃХЈЖШзюДѓЕФЪЧH2FeO4ЃЌзюаЁЕФЪЧH3FeO4+ЃЌДІгкжаМфЕФЪЧHFeO4-ЃЌЫљвдШмвКжажївЊКЌЬњЮЂСЃХЈЖШДгДѓЕНЕФаЁЕФЫГађЮЊH2FeO4ЁЂHFeO4-ЁЂH3FeO4+ЃЛFeO42-+H2O![]() HFeO4-+OH-ЕФK=
HFeO4-+OH-ЕФK=![]() ЃЌгЩHFeO4-
ЃЌгЩHFeO4-![]() H++FeO42-ЕФK3=
H++FeO42-ЕФK3=![]() ЃЌK
ЃЌK![]() K3=
K3=![]() =
=![]() KWЃЌПЩжЊK=
KWЃЌПЩжЊK=![]() ЃЌгЩЭМЯёПЩжЊpK3=-lgK3=7.3ЃЌвђДЫK3=10-7.3ЃЌЫљвдK=
ЃЌгЩЭМЯёПЩжЊpK3=-lgK3=7.3ЃЌвђДЫK3=10-7.3ЃЌЫљвдK=![]() =10-6.7ЃЌpK=-lgK=-lg10-6.7=6.7ЁЃД№АИЮЊЃКЂй1molЂкH2FeO4ЁЂHFeO4-ЁЂH3FeO4+ЁЂ6.7
=10-6.7ЃЌpK=-lgK=-lg10-6.7=6.7ЁЃД№АИЮЊЃКЂй1molЂкH2FeO4ЁЂHFeO4-ЁЂH3FeO4+ЁЂ6.7
ЃЈ3ЃЉЂйгЩЭМЯёПЩжЊЫцзХЮТЖШЕФЩ§ИпaЁЂbЁЂcЕФЗДгІжаCOЕФАйЗжКЌСПдіДѓЫЕУїaЁЂbЁЂcЮЊЗХШШЗДгІЃЌdЗДгІжаCOЕФАйЗжКЌСПМѕаЁЫЕУїdЮЊЮќШШЗДгІЃЛгЩвбжЊЗНГЬЪНЃЌИљОнИЧЫЙЖЈТЩПЩЕУd= a-3bЃЌЫљвдЁїH4 =ЁїH1-3ЁїH2ЃЛЂкдкКуШнУмБеШнЦїжаЃЌМгШы7.2gFeOЃЌЭЌЪБГфШы0.1molCOЃЌПЩЗЂЩњЗДгІFeO(s)+CO(g) ![]() Fe(s)+CO2(g)ЃЌPЕуДІЃЌCOЕФАйЗжКЌСПЮЊ75%ЃЌЩшгаxmolЕФCOВЮгыЗДгІЃЌдђ
Fe(s)+CO2(g)ЃЌPЕуДІЃЌCOЕФАйЗжКЌСПЮЊ75%ЃЌЩшгаxmolЕФCOВЮгыЗДгІЃЌдђ![]() =75%ЃЌx=0.025molЃЌCOЕФзЊЛЏТЪЮЊ
=75%ЃЌx=0.025molЃЌCOЕФзЊЛЏТЪЮЊ![]() ЃЌШнЦїжаЩњГЩЕЅжЪFeЕФжЪСПЮЊ0.025
ЃЌШнЦїжаЩњГЩЕЅжЪFeЕФжЪСПЮЊ0.025![]() =1.4 gЁЃД№АИЮЊЃКЂйdЁЂЁїH1-3ЁїH2Ђк25% ЁЂ1.4g
=1.4 gЁЃД№АИЮЊЃКЂйdЁЂЁїH1-3ЁїH2Ђк25% ЁЂ1.4g


 бєЙтПЮЬУПЮЪБгХЛЏзївЕЯЕСаД№АИ
бєЙтПЮЬУПЮЪБгХЛЏзївЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃЫЎПЊЗЂРћгУЕФВПЗжЙ§ГЬШчЭМЫљЪОЁЃЯТСагаЙиЫЕЗЈВЛе§ШЗЕФЪЧ
A. КЃЫЎЕЛЏЕФЗНЗЈжївЊгаеєСѓЗЈЁЂЕчЩјЮіЗЈЁЂРызгНЛЛЛЗЈЕШ
B. НЋТШЦјЭЈШыПрТБжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊCl2ЃЋ2BrЃ===2ClЃЃЋBr2
C. дкЙЄвЕЩЯвЛАубЁгУЧтбѕЛЏФЦШмвКзїЮЊЭМЪОжаЕФГСЕэМС
D. ФГЭЌбЇЩшМЦСЫШчЯТзАжУжЦШЁЮоЫЎMgCl2ЃЌзАжУAЕФзїгУЪЧжЦШЁИЩдяЕФHClЦјЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТСбєМЋбѕЛЏДІРэКѓаЮГЩЕФбѕЛЏФЄБШТСЕФЬьШЛбѕЛЏФЄФЭФЅадЁЂФЭИЏЪДадМАзАЪЮадгаУїЯдЕФЬсИпЃЌЙЄвЕжавдТСЮЊбєМЋЃЌжУгкСђЫсШмвКжаЕчНтЃЌзАжУШчЭМЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ 
A.бєМЋЕчМЋЗНГЬЪНЮЊAlЉ3e+6OHЉ=Al2O3+3H2O
B.ЫцзХЕчНтЕФНјааЃЌШмвКЕФpHж№НЅдіДѓ
C.ЕБвѕМЋЩњГЩЦјЬх3.36LЃЈБъПіЃЉЪБЃЌбєМЋдіжи2.4g
D.ЕчНтЙ§ГЬжаH+вЦЯђAlЕчМЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђДњСђЫсФЦ(Na2S2O3)ОпгаНЯЧПЕФЛЙдадЃЌЛЙФмгыжаЧПЫсЗДгІЃЌдкОЋЯИЛЏЙЄСьгђгІгУЙуЗКЁЃНЋSO2ЭЈШыАДвЛЖЈБШР§ХфжЦГЩЕФNa2SКЭNa2CO3ЕФЛьКЯШмвКжаЃЌПЩжЦЕУNa2S2O3ЁЄ5H2O(ДѓЫеДђ)ЁЃ
вбжЊЃКNa2SЁЂNa2CO3ЁЂNa2SO3ЁЂNaHCO3ШмвКГЪМюадЃЛNaHSO3ШмвКГЪЫсадЁЃ
(1)ЪЕбщЪвгУNa2SO3КЭСђЫсжЦБИSO2ЃЌПЩбЁгУЕФЦјЬхЗЂЩњзАжУЪЧ________(ЬюзжФИДњКХ)ЁЃ
(2)ЯђNa2SКЭNa2CO3ЕФЛьКЯШмвКжаВЛЖЯЭЈШыSO2ЦјЬхЕФЙ§ГЬжаЃЌЗЂЯжЃК
ЂйЧГЛЦЩЋГСЕэЯШж№НЅдіЖрЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____________________________________ЃЛ
ЂкЕБЧГЛЦЩЋГСЕэВЛдйдіЖрЪБЃЌЗДгІЬхЯЕжагаЮоЩЋЮоЮЖЕФЦјЬхВњЩњЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________________________________ЃЛ
ЂлЧГЛЦЩЋГСЕэж№НЅМѕЩй(етЪБгаNa2S2O3ЩњГЩ)ЃЛ
ЂмМЬајЭЈШыЙ§СПЕФSO2ЃЌЧГЛЦЩЋГСЕэгжЛсж№НЅдіЖрЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________________________ЁЃ
(3)жЦБИNa2S2O3ЪБЃЌЮЊСЫЪЙЗДгІЮяРћгУТЪзюДѓЛЏЃЌNa2SКЭNa2CO3ЕФЮяжЪЕФСПжЎБШгІЮЊ____________ЃЛЭЈЙ§ЗДгІЫГађЃЌПЩБШНЯГіЃКЮТЖШЯрЭЌЪБЃЌЭЌЮяжЪЕФСПХЈЖШЕФNa2SШмвККЭNa2CO3ШмвКpHИќДѓЕФЪЧ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЃКЯзїбЇЯАаЁзщЕФЭЌбЇЩшМЦгУМзЫсФЦЗЈжЦШЁБЃЯеЗл(Na2S2O4)ВЂВтЖЈЦфДПЖШЁЃвбжЊБЃЯеЗлвзШмгкЫЎЃЌВЛШмгкМзДМЃЌОпгаЧПЛЙдадЁЃЛиД№ЯТСаЮЪЬт:
ЃЈ1ЃЉБЃЯеЗлЕФжЦБИЁЃЩшМЦЕФЪЕбщзАжУШчЯТЭМЫљЪО(МаГжКЭМгШШзАжУЪЁТд):

ЂйЪЂЗХХЈСђЫсЕФвЧЦїУћГЦЮЊ____________ЃЌзАжУAЪЧЮЊСЫжЦБИ______(ЬюЛЏбЇЪН)ЁЃ
ЂкзАжУBжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ_____________________________________________ЃЌИУЗДгІЮТЖШашПижЦдк70~75ЁцНјааЃЌЪЪвЫЕФМгШШЗНЪНЪЧ_____________ЃЌгУМзДМЫЎШмвКДњЬцЫЎЕФФПЕФЪЧ______________________________ЁЃ
ЂлзАжУCЕФзїгУЪЧ________________ЃЛзАжУDЕФзїгУЪЧ__________________________ЁЃ
ЃЈ2ЃЉВњЦЗжаNa2S2O4ЕФжЪСПЗжЪ§ЕФВтЖЈЃЌЦфЪЕбщВНжшШчЯТ:
I.зМШЗГЦШЁagВњЦЗЗХШызЖаЮЦПжаЃЌМгШыЪЪСПЕФЫЎЪЙЦфШмНтЃЌШЛКѓМгШызуСПМзШЉЃЌГфЗжЗДгІЃЛ
II.дйЕЮМгМИЕЮЕэЗлШмвКЃЌгУc mol/LЕФБъзМI2ШмвКЕЮЖЈЃЌжСжеЕуЪБЃЌЯћКФVmLI2ШмвКЁЃ
ЪЕбщжаЩцМАЕФЗДгІга: Na2S2O4+2HCHO+H2O==NaHSO3ЁЄCH2O+NaHSO2ЁЄCH2OЃЛNaHSO3ЁЄCH2O +2 I2+2H2O==NaHSO4+HCHO+4HIЁЃ
ЂйВНжшIIЕЮЖЈжСжеЕуЕФЯжЯѓЪЧ_________________________________________ЁЃ
ЂкВњЦЗжаNa2S2O4ЕФжЪСПЗжЪ§ЮЊ__________________________(гУКЌaЁЂcЁЂVЕФДњЪ§ЪНБэЪО)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГдзгЕФЕчзгХХВМЪНЮЊ1s22s22p63s23p63d54s2ЃЌЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧ( )
A. ИУдЊЫидзгжаЙВга25ИіЕчзг
B. ИУдЊЫидзгКЫЭтга4ИіФмВу
C. ИУдЊЫидзгзюЭтВуЙВга2ИіЕчзг
D. ИУдЊЫидзгMЕчзгВуЙВга8ИіЕчзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЯђ10mL0.1mol/L NaOHШмвКжаМгШы0.1mol/LЕФвЛдЊЫсHAЃЌШмвКpHЕФБфЛЏЧњЯпШчъ\ЫљЪОЃЎЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ 
A.a ЕуЫљЪОШмвКжа cЃЈNa+ЃЉЃОcЃЈAЉЃЉЃОcЃЈH+ЃЉЃОcЃЈHAЃЉ
B.aЁЂb СНЕуЫљЪОШмвКжаЫЎЕФЕчРыГЬЖШЯрЮЪ
C.bЕуЫљЪОШмвКжаcЃЈAЉЃЉЃОcЃЈHAЃЉ
D.pH=7ЪБЃЌcЃЈNa+ЃЉЉ=cЃЈAЉЃЉ+cЃЈHAЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЬѕМўЯТе§ЮьЭщ(CH3CH2CH2CH2CH3)взЗЂЩњСНжжСбНтЗДгІ:
I.CH3CH2CH2CH2CH3(g)![]() CH3CH=CH2(g)+CH3CH3(g) ЁїH1=+274.2kJ/molЃЛ
CH3CH=CH2(g)+CH3CH3(g) ЁїH1=+274.2kJ/molЃЛ
II.CH3CH2CH2CH2CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) ЁїH2=+122.7kJ/molЁЃ
CH3CH2CH3(g)+CH2=CH2(g) ЁїH2=+122.7kJ/molЁЃ
ЃЈ1ЃЉЮЌГжЬхЯЕЮТЖШTВЛБфЃЌзмбЙЧПpКуЖЈЪБЃЌЬхЛ§ЮЊV1LЕФе§ЮьЭщЗЂЩњСбНтЗДгІЃЌвЛЖЮЪБМфЦНКтКѓЦјЬхЬхЛ§БфЮЊV2LЃЌДЫЪБе§ЮьЭщЕФзЊЛЏТЪІС(е§ЮьЭщ)=_______ЃЛЮЌГжЬхЯЕЮТЖШВЛБфЃЌЯђЬхЯЕжаГфШывЛЖЈСПЕФЫЎеєЦј(ЫЎеєЦјдкИУЬѕМўЯТВЛВЮгыЗДгІ)ЃЌдйДЮЦНКтКѓе§ЮьЭщЕФзЊЛЏТЪНЋ______(ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ)ЃЌдвђЮЊ_____________ЁЃ
ЃЈ2ЃЉвЛЖЈЮТЖШЯТЃЌЯђЬхЛ§ЮЊ2LЕФУмБеШнЦїжаГфШы0.2molCH3CH=CH2КЭ0.5molCH3CH3ЗЂЩњЗДгІCH3CH=CH2(g)+CH3CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) ЁїH3ЃЛ5minКѓДяЕНЦНКтзДЬЌЃЌШнЦїФкЪЃгрCH3CH=CH2ЕФЮяжЪЕФСПЮЊ0.1molЁЃ
CH3CH2CH3(g)+CH2=CH2(g) ЁїH3ЃЛ5minКѓДяЕНЦНКтзДЬЌЃЌШнЦїФкЪЃгрCH3CH=CH2ЕФЮяжЪЕФСПЮЊ0.1molЁЃ
ЂйЁїH3=________ЁЃ
Ђк5minФкЃЌИУЗДгІЕФЦНОљЗДгІЫйТЪv(CH3CH3)=________ЁЃ
ЂлБЃГжЮТЖШВЛБфЃЌЦ№ЪМЪБЯђИУУмБеШнЦїжаГфШыЕШЮяжЪЕФСПЕФCH3CH=CH2КЭCH3CH3ЃЌЦНКтКѓШнЦїФкCH3CH3ЕФЬхЛ§ЗжЪ§ЮЊ______(БЃСєвЛЮЛаЁЪ§)ЁЃ
ЃЈ3ЃЉНЋ0.1molCH3CH3ЭъШЋШМЩеКѓЕФЦјЬхЭЈШы100mLвЛЖЈХЈЖШЕФNaOHШмвКжаЃЌВЂНЋЫљЕУШмвКЯЁЪЭжС1LЁЃзюжеЫљЕУШмвКжаCO32-ЁЂHCO3-ЁЂH2CO3Ш§епЫљеМЮяжЪЕФСПЗжЪ§ЫцдNaOHШмвКХЈЖШБфЛЏЕФЙиЯЕШчЭМЫљЪО:
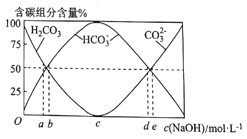
ЦфжаЭМжаБэЪОдЧтбѕЛЏФЦХЈЖШЮЊ3mol.L-1ЕФЪЧ_____(ЬюЁАaЁБЁАbЁБЁАcЁБЁАdЁБЛђЁАeЁБ)ЁЃ
ЃЈ4ЃЉвдЧтбѕЛЏФЦШмвКЮЊЕчНтжЪШмвКЃЌCH3CH3ШМСЯЕчГиЕФИКМЋЗДгІЪНЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПН№ЪєФјМАЦфЛЏКЯЮядкКЯН№ВФСЯМАДпЛЏМСЕШЗНУцгІгУЙуЗКЁЃФГПѓдќЕФжївЊГЩЗжЪЧNiFe2O4(ЬњЫсФј)ЁЂNiOЁЂFeOЁЂCaOЁЂSiO2ЕШЃЌвдЯТЪЧДгИУПѓдќжаЛиЪеNiSO4ЕФЙЄвеСїГЬЃК

вбжЊЃК(NH4)2SO4дк350ЁцвдЩЯЛсЗжНтЩњГЩNH3КЭH2SO4ЁЃNiFe2O4дкБКЩеЙ§ГЬжаЩњГЩNiSO4ЁЂFe2(SO4)3ЁЃ
(1)БКЩеЧАНЋПѓдќгы(NH4)2SO4ЛьКЯбаФЅЃЌЛьКЯбаФЅЕФФПЕФЪЧ______________________ЁЃ
(2)ЁАНўХнЁБЙ§ГЬжаFe2(SO4)3ЩњГЩFeO(OH)ЕФРызгЗНГЬЪНЮЊ___________________ЃЌЁАНўдќЁБЕФГЩЗжГ§Fe2O3ЃЌFeO(OH)ЭтЛЙКЌга______________(ЬюЛЏбЇЪН)ЁЃ
(3)ЮЊБЃжЄВњЦЗДПЖШЃЌвЊМьВтЁАНўГівКЁБЕФзмЬњСПЃКШЁвЛЖЈЬхЛ§ЕФНўГівКЃЌгУбЮЫсЫсЛЏКѓЃЌМгШыSnC12НЋFe3+ЛЙдЮЊFe2+ЃЌЫљашSnC12ЕФЮяжЪЕФСПВЛЩйгкFe3+ЮяжЪЕФСПЕФ_____БЖЃЛГ§ШЅЙ§СПЕФSnC12КѓЃЌдйгУЫсадK2Cr2O7БъзМШмвКЕЮЖЈШмвКжаЕФFe2+ЃЌЕЮЖЈЪБЗДгІЕФРызгЗНГЬЪНЮЊ____________ЁЃ
(4)ЁАНўГівКЁБжаc(Ca2+)=1.0ЁС10-3molЃЌЕБГ§ИЦТЪДяЕН99ЃЅЪБЃЌГ§ИЦКѓЕФШмвКжаc(F-)=____molЁЄL-1[вбжЊKsp(CaF2)=4.0ЁС10-11]ЁЃ
(5)БОЙЄвежаЃЌнЭШЁМСгыШмвКЕФЬхЛ§БШ(V0ЃЏVA)ЖдШмвКжаNi2+ЁЂFe2+ЕФнЭШЁТЪгАЯьШчЭМЫљЪОЃЌV0ЃЏVAЕФзюМбШЁжЕЪЧ______________ЁЃ
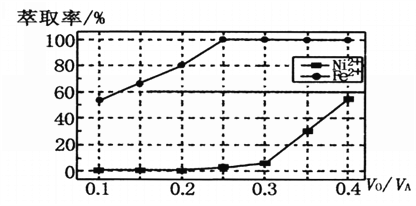
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com