
【题目】某校合作学习小组的同学设计用甲酸钠法制取保险粉(Na2S2O4)并测定其纯度。已知保险粉易溶于水,不溶于甲醇,具有强还原性。回答下列问题:
(1)保险粉的制备。设计的实验装置如下图所示(夹持和加热装置省略):

①盛放浓硫酸的仪器名称为____________,装置A是为了制备______(填化学式)。
②装置B中发生反应的离子方程式为_____________________________________________,该反应温度需控制在70~75℃进行,适宜的加热方式是_____________,用甲醇水溶液代替水的目的是______________________________。
③装置C的作用是________________;装置D的作用是__________________________。
(2)产品中Na2S2O4的质量分数的测定,其实验步骤如下:
I.准确称取ag产品放入锥形瓶中,加入适量的水使其溶解,然后加入足量甲醛,充分反应;
II.再滴加几滴淀粉溶液,用c mol/L的标准I2溶液滴定,至终点时,消耗VmLI2溶液。
实验中涉及的反应有: Na2S2O4+2HCHO+H2O==NaHSO3·CH2O+NaHSO2·CH2O;NaHSO3·CH2O +2 I2+2H2O==NaHSO4+HCHO+4HI。
①步骤II滴定至终点的现象是_________________________________________。
②产品中Na2S2O4的质量分数为__________________________(用含a、c、V的代数式表示)。
【答案】 分液漏斗 SO2 2HCOO-+CO32-+4SO2==2S2O42-+3CO2+H2O 水浴加热 减小Na2S2O4的溶解度,提高产率 安全瓶 尾气处理 溶液由无色变为蓝色且半分钟内不褪去 (l74cV×10-3/2a)×100%
【解析】(1)①盛放浓硫酸的仪器名称为分液漏斗, 装置A中浓硫酸和亚硫酸钠反应生成SO2、Na2SO4、H2O ,主要目的是制备SO2。②装置B中HCOONa、Na2CO3和SO2反应,发生反应的离子方程式为2HCOO-+CO32-+4SO2==2S2O42-+3CO2+H2O;该反应温度需控制在70~75℃进行,温度低于100℃,最好用水浴加热;Na2S2O4在甲醇水溶液中的溶解度小于在水中的溶解度,用甲醇水溶液代替水溶液能减小Na2S2O4的溶解度,提高产率。③B中过量的SO2以及产生的CO2都易被D中的NaOH溶液所吸收,容易发生倒吸,因此C装置是防倒吸,起到安全瓶的作用,装置D吸收尾气。
答案为:①分液漏斗 、SO2 ②2HCOO-+CO32-+4SO2==2S2O42-+3CO2+H2O、水浴加热、减小Na2S2O4的溶解度,提高产率③安全瓶、 尾气处理
(2)①步骤II中用淀粉溶液作指示剂,在滴定结束之前,溶液中碘不足,溶液为无色,当碘单质过量后,溶液中的淀粉与碘单质显示蓝色,所以滴定至终点的现象为:溶液由无色变为蓝色且半分钟内不褪去。
②由方程式Na2S2O4+2HCHO+H2O==NaHSO3·CH2O+NaHSO2·CH2O; NaHSO3·CH2O +2 I2+2H2O==NaHSO4+HCHO+4HI 可得关系式:1mol Na2S2O4─2mol I2,所以产品中Na2S2O4的质量分数=![]()
![]() =(l74cV×10-3/2a)×100% 答案为:①溶液由无色变为蓝色且半分钟内不褪去②(l74cV×10-3/2a)×100%
=(l74cV×10-3/2a)×100% 答案为:①溶液由无色变为蓝色且半分钟内不褪去②(l74cV×10-3/2a)×100%


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:
【题目】向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( ) 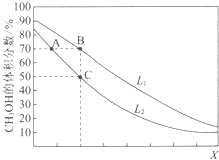
A.X代表压强
B.L1<L2
C.平衡常数:K(A)=K(B)
D.在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验: 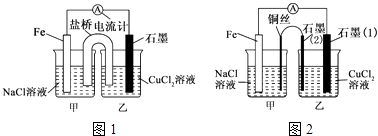
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为 . 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过mol电子.
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式 , 这是由于NH4Cl溶液显(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因 .
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨为极(填正、负、阴、阳),乙装置中与铜线相连的石墨(2)电极上发生的反应式为 .
(4)在图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重 1.28g,则此时溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的单质及其作合物用途非常广泛。回答下列问题:
(1)某热电池放电时总反应为4Li+FeS2==Fe+2Li2S。该电池的正、负极材料分别是_______、____。
(2)Na2FeO4是一种优良的水处理剂。
①Na2FeO4可将水体中NH3转化为N2而除去同时产生红褐色沉淀,1mol Na2FeO4最多可脱除NH3的物质的量为______________________。
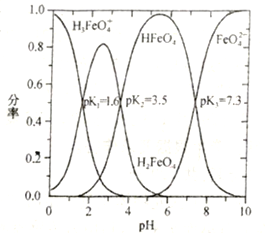
②Na2FeO4溶于水,溶液中含六价铁的微粒分率(某六价铁微粒数与所有六价铁微粒总数之比)与溶液pH关系如下图所示(已知常温下,H3FeO4+![]() H++H2FeO4,H2FeO4
H++H2FeO4,H2FeO4![]() H++HFeO4-,HFeO4-
H++HFeO4-,HFeO4-![]() H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O
H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O![]() HFeO4-+OH-的pK=______。
HFeO4-+OH-的pK=______。
(3)CO还原铁的氧化物时,涉及以下反应:
a.Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H1
3Fe(s)+4CO2(g)△H1
b.FeO(g)+CO(g) ![]() Fe(s)+CO2(g)△H2
Fe(s)+CO2(g)△H2
c.3Fe2O3(s)+CO(g) ![]() 2 Fe3O4 (s)+CO2(g)△H3
2 Fe3O4 (s)+CO2(g)△H3
d. Fe3O4 (s)+CO(g) ![]() 3FeO(s)+CO2(g)△H4
3FeO(s)+CO2(g)△H4
相关反应的温度与混合气体中CO的体积分数的关系如下图所示:
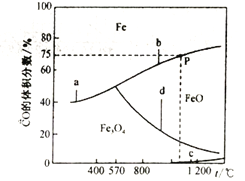
①反应的△H>0的是__________(选填a、b、c、d);△H4 =_______(用△H1、△H2表示)。
②在恒容密闭容器中,加入7.2gFeO,同时充入0.1molCO,升高温度,若恰好处于图中P点处,CO的转化率为_______,容器中生成单质Fe的质量为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为![]() a nm 的In 原子有________个。
a nm 的In 原子有________个。
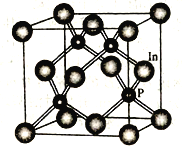
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是

A. 外电路的电流方向为X![]() 外电路
外电路![]() Y
Y
B. 若两电极分别为Fe和碳棒,则X 为碳棒,Y 为Fe
C. X 极上发生的是还原反应,Y 极上发生的是氧化反应
D. 若两电极都是金属,则它们的活泼性顺序为X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com