
【题目】下列属于电解质的是( )
A.蔗糖
B.盐酸
C.酒精
D.氢氧化钠
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某校合作学习小组的同学设计用甲酸钠法制取保险粉(Na2S2O4)并测定其纯度。已知保险粉易溶于水,不溶于甲醇,具有强还原性。回答下列问题:
(1)保险粉的制备。设计的实验装置如下图所示(夹持和加热装置省略):

①盛放浓硫酸的仪器名称为____________,装置A是为了制备______(填化学式)。
②装置B中发生反应的离子方程式为_____________________________________________,该反应温度需控制在70~75℃进行,适宜的加热方式是_____________,用甲醇水溶液代替水的目的是______________________________。
③装置C的作用是________________;装置D的作用是__________________________。
(2)产品中Na2S2O4的质量分数的测定,其实验步骤如下:
I.准确称取ag产品放入锥形瓶中,加入适量的水使其溶解,然后加入足量甲醛,充分反应;
II.再滴加几滴淀粉溶液,用c mol/L的标准I2溶液滴定,至终点时,消耗VmLI2溶液。
实验中涉及的反应有: Na2S2O4+2HCHO+H2O==NaHSO3·CH2O+NaHSO2·CH2O;NaHSO3·CH2O +2 I2+2H2O==NaHSO4+HCHO+4HI。
①步骤II滴定至终点的现象是_________________________________________。
②产品中Na2S2O4的质量分数为__________________________(用含a、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由阿伏伽德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水),不能确定的物理量有( )
A.1摩尔水的质量
B.1摩尔水蒸气的质量
C.1摩尔水的体积
D.1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为( )
①a-4 ②a-5 ③a+3 ④a+4
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是
A. 苯的硝化反应的化学方程式:![]() +HO-NO2
+HO-NO2![]()
![]() +H2O
+H2O
B. 电解饱和氯化铜溶液(惰性电极)的阳极反应式:Cu2++2e-=Cu
C. 打磨过的镁条与热水反应的离子反应式:Mg+2H+=Mg2++H2↑
D. 燃煤烟气用氨水法脱硫的化学反应式:4NH3·H20+2SO2+O2=2(NH4)2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料及催化剂等方面应用广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺流程:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___________________,“浸渣”的成分除Fe2O3,FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnC12将Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnC12后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,滴定时反应的离子方程式为____________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol,当除钙率达到99%时,除钙后的溶液中c(F-)=____mol·L-1[已知Ksp(CaF2)=4.0×10-11]。
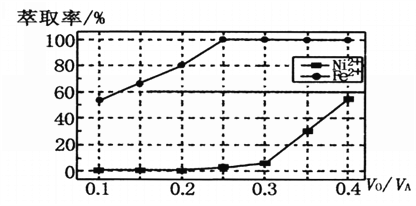
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(气体体积已折算为标准状况下的体积)。下列分析正确的是

A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
C. OE、EF、FG三段中,用二氧化碳表示该反应的平均反应速率之比为2:6:7
D. G点CO2不再增加的原因可能是盐酸的浓度过低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排、开发新能源目前受到国际社会的高度关注。
(1)近年我国努力开发新能源,调整能源结构。下列属于可再生能源的是_______(填字母)。
A.氢能 B.天然气 C.石油 D.生物质能
(2)工业生产中会产生SO2、H2S等有害气体,可采取多种方法进行处理。
I.生物法脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(S04)3+2H2O
2Fe2(S04)3+2H2O
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______。
②由图1和图2判断使用硫杆菌的最佳条件为_____。若反应温度过高,反应速率下降,其原因是_____。

I.双碱法去除SO2的原理是先用NaOH溶液吸收SO2,再用CaO使NaOH再生。
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
写出过程①的离子方程式:______________。
(3)人们也利用多种方法回收利用烟气用的有害气体,变废为宝。如果利用NaOH溶液、石灰和O2处理硫酸工厂尾气中的SO2使之最终转化为石膏(CaSO4·2H2O),假设硫元素不损失,每天处理1000m3(标准状况)含0.2%(体积分数)SO2的尾气,理论上可以得到多少千克石膏 (计算结果保留小数点后一位)?_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是A、B、C、D、E、F等几种常见有机物之间的转化关系图,其中A是面粉的主要成分;C和E反应能生成F,F具有香味,B与E的实验式相同。
![]()
根据以上信息及各物质的转化关系完成下列各题:
(1)B的化学式为_____,C中所含官能团名称_____,与B同分异构体的一种物质的名称___。
(2)D与新制银氨溶液在水浴加热条件下发生反应的离子方程式________。
(3)其中能与新制氢氧化铜悬浊液在加热煮沸条件下能产生砖红色的沉定的物质有_______(填名称)。
(4)写出C→D的化学方程式________。
(5)写出C+E→F的化学方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com