
【题目】铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( ) 
A.阳极电极方程式为Al﹣3e+6OH﹣=Al2O3+3H2O
B.随着电解的进行,溶液的pH逐渐增大
C.当阴极生成气体3.36L(标况)时,阳极增重2.4g
D.电解过程中H+移向Al电极
【答案】C
【解析】解:A、电解质为硫酸溶液,氢氧根离子不可能参加反应,阳极反应为:Al﹣3e﹣=3Al3+,故A错误;
B、根据原电池装置和题目信息可知电解总反应为:2Al+3H2O ![]() Al2O3+3H2↑,水减少,溶液的pH逐渐减小,故B错误;
Al2O3+3H2↑,水减少,溶液的pH逐渐减小,故B错误;
C、阴极反应为:2H+﹣2e﹣=H2↑,氢气的物质的量为: ![]() =0.15mol,则转移的电子的物质的量为:2×0.15mol=0.3mol,阳极反应为:2Al+3H2O﹣6e﹣=Al2O3+6H+;根据质量差法进行计算:设阳极增重的质量为x,
=0.15mol,则转移的电子的物质的量为:2×0.15mol=0.3mol,阳极反应为:2Al+3H2O﹣6e﹣=Al2O3+6H+;根据质量差法进行计算:设阳极增重的质量为x,
2Al+3H2O﹣ | 6e﹣=Al2O3 +6H+ | △m |
6mol | 48g | |
0.3mol | x |
6mol:0.3mol=48g:x,
解得x=2.4g,即阳极增重2.4g,故C正确;
D、根据电流方向可知,阳离子向着阴极移动,铝为阳极,石墨为阴极,所以氢离子向着石墨移动,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】中医典籍《肘后备急方》所载治疗疟疾的方法“青蒿一握,以水二升渍,绞取汁,尽服之”, 对屠呦呦团队研发治疗疟疾的特效药——青蒿素有巨大的启示作用。屠呦呦在对比实验中发现古法疗效低下,她设计的提取青蒿素的工艺可以简化成如下流程:
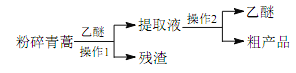
根据上述信息分析,下列判断或叙述中肯定错误的是
A. 从天然植物中提取有效成分治疗疾病是药物研发的重要途径
B. 将青蒿粉碎可以提高有效成分的提取率
C. 青蒿素易溶于水和乙醚
D. 操作 1 是过滤,操作 2 是蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据物质在生产、生活等方面的应用填空。
(1)厨房里常使用小苏打,向其水溶液中滴加酚酞溶液后,溶液呈__________(填字母代号)。
a.浅蓝色 b.浅红色 c.浅绿色
(2)检验某补铁剂中的Fe2+是否被氧化成Fe3+,可用__________溶液(填字母代号)。
a.NaOH b.H2O2 c.KSCN
(3)电解氧化铝时加入冰晶石的作用为________________。
(4)完成乙醇发生催化氧化的化学方程式:2CH3CH2OH+O2![]() _________________________。
_________________________。
(5)常见的酸性锌锰电池的负极材料为Zn,请写出负极的电极反应式:___________________。
(6)铝热反应是工业上常用的反应之一,请写出Al与Fe3O4发生铝热反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( ) 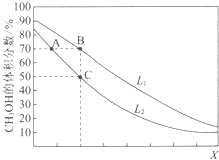
A.X代表压强
B.L1<L2
C.平衡常数:K(A)=K(B)
D.在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下所示:
第一步:CH3CH2OH ![]() CH2=CH2+H2O;
CH2=CH2+H2O;
第二步:乙烯与溴水反应得到1,2-二溴乙烷。
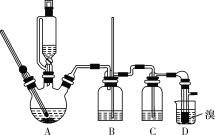
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点/(℃) | 78.5 | 132 | 34.6 |
熔点/(℃) | -130 | 9 | -116 |
请回答下列问题:
(1)写出乙烯与溴水反应的化学方程式:___________________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是___________(填字母代号)。
a.引发反应 b.加快反应速率
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是__________________。
(4)在装置C中应加入_________(填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________(填“上”或“下”)层。
(6)若产物中有少量未反应的Br2,最好用________(填字母代号)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用__________的方法除去。
(8)判断该制备反应已经结束的最简单方法是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的单质及其作合物用途非常广泛。回答下列问题:
(1)某热电池放电时总反应为4Li+FeS2==Fe+2Li2S。该电池的正、负极材料分别是_______、____。
(2)Na2FeO4是一种优良的水处理剂。
①Na2FeO4可将水体中NH3转化为N2而除去同时产生红褐色沉淀,1mol Na2FeO4最多可脱除NH3的物质的量为______________________。
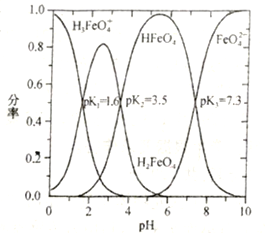
②Na2FeO4溶于水,溶液中含六价铁的微粒分率(某六价铁微粒数与所有六价铁微粒总数之比)与溶液pH关系如下图所示(已知常温下,H3FeO4+![]() H++H2FeO4,H2FeO4
H++H2FeO4,H2FeO4![]() H++HFeO4-,HFeO4-
H++HFeO4-,HFeO4-![]() H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O
H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O![]() HFeO4-+OH-的pK=______。
HFeO4-+OH-的pK=______。
(3)CO还原铁的氧化物时,涉及以下反应:
a.Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H1
3Fe(s)+4CO2(g)△H1
b.FeO(g)+CO(g) ![]() Fe(s)+CO2(g)△H2
Fe(s)+CO2(g)△H2
c.3Fe2O3(s)+CO(g) ![]() 2 Fe3O4 (s)+CO2(g)△H3
2 Fe3O4 (s)+CO2(g)△H3
d. Fe3O4 (s)+CO(g) ![]() 3FeO(s)+CO2(g)△H4
3FeO(s)+CO2(g)△H4
相关反应的温度与混合气体中CO的体积分数的关系如下图所示:
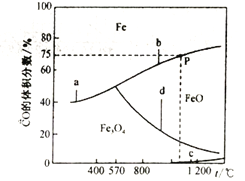
①反应的△H>0的是__________(选填a、b、c、d);△H4 =_______(用△H1、△H2表示)。
②在恒容密闭容器中,加入7.2gFeO,同时充入0.1molCO,升高温度,若恰好处于图中P点处,CO的转化率为_______,容器中生成单质Fe的质量为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数值用NA表示。下列说法中正确的是
A. 50 g 46%的乙醇水溶液中含有的氢原子总数为6NA
B. NH4N3(叠氮化铵)发生爆炸:NH4N3![]() 2N2↑+2H2↑当转移4NA个电子时,产生44.8L(标准状况)混合气体
2N2↑+2H2↑当转移4NA个电子时,产生44.8L(标准状况)混合气体
C. 0.1molSO2溶于水,溶液中SO32-、HSO3-、H2SO3的总数为0.1NA
D. 用铂电极电解100 mL 1 mol L-1的CuSO4溶液足够长时间,转移的电子数一定为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com