
【题目】室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( ) 
A.a 点所示溶液中 c(Na+)>c(A﹣)>c(H+)>c(HA)
B.a、b 两点所示溶液中水的电离程度相问
C.b点所示溶液中c(A﹣)>c(HA)
D.pH=7时,c(Na+)﹣=c(A﹣)+c(HA)
科目:高中化学 来源: 题型:
【题目】铁的单质及其作合物用途非常广泛。回答下列问题:
(1)某热电池放电时总反应为4Li+FeS2==Fe+2Li2S。该电池的正、负极材料分别是_______、____。
(2)Na2FeO4是一种优良的水处理剂。
①Na2FeO4可将水体中NH3转化为N2而除去同时产生红褐色沉淀,1mol Na2FeO4最多可脱除NH3的物质的量为______________________。
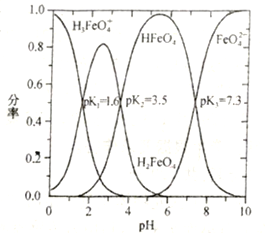
②Na2FeO4溶于水,溶液中含六价铁的微粒分率(某六价铁微粒数与所有六价铁微粒总数之比)与溶液pH关系如下图所示(已知常温下,H3FeO4+![]() H++H2FeO4,H2FeO4
H++H2FeO4,H2FeO4![]() H++HFeO4-,HFeO4-
H++HFeO4-,HFeO4-![]() H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O
H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O![]() HFeO4-+OH-的pK=______。
HFeO4-+OH-的pK=______。
(3)CO还原铁的氧化物时,涉及以下反应:
a.Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H1
3Fe(s)+4CO2(g)△H1
b.FeO(g)+CO(g) ![]() Fe(s)+CO2(g)△H2
Fe(s)+CO2(g)△H2
c.3Fe2O3(s)+CO(g) ![]() 2 Fe3O4 (s)+CO2(g)△H3
2 Fe3O4 (s)+CO2(g)△H3
d. Fe3O4 (s)+CO(g) ![]() 3FeO(s)+CO2(g)△H4
3FeO(s)+CO2(g)△H4
相关反应的温度与混合气体中CO的体积分数的关系如下图所示:
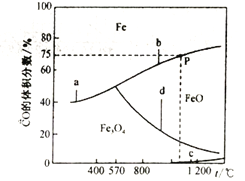
①反应的△H>0的是__________(选填a、b、c、d);△H4 =_______(用△H1、△H2表示)。
②在恒容密闭容器中,加入7.2gFeO,同时充入0.1molCO,升高温度,若恰好处于图中P点处,CO的转化率为_______,容器中生成单质Fe的质量为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
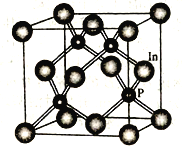
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为![]() a nm 的In 原子有________个。
a nm 的In 原子有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A.BaCl2=Ba++2Cl-B.NaOH=Na++OH-
C.H2SO4= H22++SO42-D.KNO3=K++N5++3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是

A. 外电路的电流方向为X![]() 外电路
外电路![]() Y
Y
B. 若两电极分别为Fe和碳棒,则X 为碳棒,Y 为Fe
C. X 极上发生的是还原反应,Y 极上发生的是氧化反应
D. 若两电极都是金属,则它们的活泼性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数值用NA表示。下列说法中正确的是
A. 50 g 46%的乙醇水溶液中含有的氢原子总数为6NA
B. NH4N3(叠氮化铵)发生爆炸:NH4N3![]() 2N2↑+2H2↑当转移4NA个电子时,产生44.8L(标准状况)混合气体
2N2↑+2H2↑当转移4NA个电子时,产生44.8L(标准状况)混合气体
C. 0.1molSO2溶于水,溶液中SO32-、HSO3-、H2SO3的总数为0.1NA
D. 用铂电极电解100 mL 1 mol L-1的CuSO4溶液足够长时间,转移的电子数一定为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行实验,能达到相应实验目的的是

A. 图甲可用于蒸馏石油并收集60~150℃馏分
B. 图乙可用于除去乙烯气体中混有的少量SO2
C. 图丙装置可用于比较S、C、Si三种元素的非金属性
D. 图丁装置可用于测定CO2的生成速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com