
【题目】下列电离方程式书写正确的是
A.BaCl2=Ba++2Cl-B.NaOH=Na++OH-
C.H2SO4= H22++SO42-D.KNO3=K++N5++3O2-
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关描述中正确的是( )
A.牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀
B.AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同
C.室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。
已知:Na2S、Na2CO3、Na2SO3、NaHCO3溶液呈碱性;NaHSO3溶液呈酸性。
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填字母代号)。
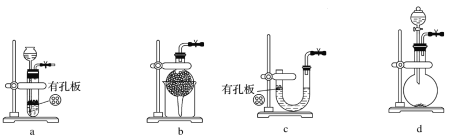
(2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为_____________________________________;
②当浅黄色沉淀不再增多时,反应体系中有无色无味的气体产生,反应的化学方程式为________________________________;
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入过量的SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为________________________。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )
A. 该元素原子中共有25个电子
B. 该元素原子核外有4个能层
C. 该元素原子最外层共有2个电子
D. 该元素原子M电子层共有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( ) 
A.a 点所示溶液中 c(Na+)>c(A﹣)>c(H+)>c(HA)
B.a、b 两点所示溶液中水的电离程度相问
C.b点所示溶液中c(A﹣)>c(HA)
D.pH=7时,c(Na+)﹣=c(A﹣)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如图所示。下列叙述错误的是
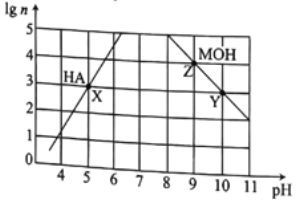
A. MOH为强碱,HA为弱酸
B. 水的电离程度:X=Y>Z
C. 若升高温度,Y、Z点对应溶液的pH值均减小
D. 将X点溶液与Z点溶液等体积混合,所得溶液中c(A-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下正戊烷(CH3CH2CH2CH2CH3)易发生两种裂解反应:
I.CH3CH2CH2CH2CH3(g)![]() CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
CH3CH=CH2(g)+CH3CH3(g) △H1=+274.2kJ/mol;
II.CH3CH2CH2CH2CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
CH3CH2CH3(g)+CH2=CH2(g) △H2=+122.7kJ/mol。
(1)维持体系温度T不变,总压强p恒定时,体积为V1L的正戊烷发生裂解反应,一段时间平衡后气体体积变为V2L,此时正戊烷的转化率α(正戊烷)=_______;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将______(填“增大”“减小”或“不变”),原因为_____________。
(2)一定温度下,向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5molCH3CH3发生反应CH3CH=CH2(g)+CH3CH3(g)![]() CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
CH3CH2CH3(g)+CH2=CH2(g) △H3;5min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
①△H3=________。
②5min内,该反应的平均反应速率v(CH3CH3)=________。
③保持温度不变,起始时向该密闭容器中充入等物质的量的CH3CH=CH2和CH3CH3,平衡后容器内CH3CH3的体积分数为______(保留一位小数)。
(3)将0.1molCH3CH3完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
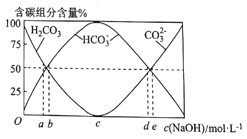
其中图中表示原氢氧化钠浓度为3mol.L-1的是_____(填“a”“b”“c”“d”或“e”)。
(4)以氢氧化钠溶液为电解质溶液,CH3CH3燃料电池的负极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年新学期初,市教育局在全市中小学开展了“节约用水用电,倡导绿色简约生活”的活动。下列做法不应该提倡的是
A.路远的同学可乘公交车上学B.作业不要使用修正带或涂改液
C.将化学实验室的废水直接排入水池D.养成随手关水关灯的习惯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: . X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为 .
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号) .
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式) , 原因是 .
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式: .
(5)R的一种配合物的化学式为RCl36H2O.已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O
D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为: , 继续滴加氨水至过量,沉淀溶解, 得到天蓝色溶液,写反应的离子方程式为: .
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 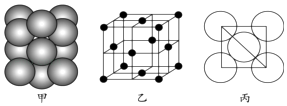
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为gcm﹣3(用字母表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com