
【题目】某原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )
A. 该元素原子中共有25个电子
B. 该元素原子核外有4个能层
C. 该元素原子最外层共有2个电子
D. 该元素原子M电子层共有8个电子
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是
A. 操作①和③中的有机相从分液漏斗上端倒出
B. 操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42-
C. 操作④为过滤
D. 操作⑤可用如图所示的水浴装置进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下所示:
第一步:CH3CH2OH ![]() CH2=CH2+H2O;
CH2=CH2+H2O;
第二步:乙烯与溴水反应得到1,2-二溴乙烷。
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):
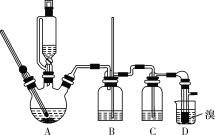
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点/(℃) | 78.5 | 132 | 34.6 |
熔点/(℃) | -130 | 9 | -116 |
请回答下列问题:
(1)写出乙烯与溴水反应的化学方程式:___________________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是___________(填字母代号)。
a.引发反应 b.加快反应速率
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是__________________。
(4)在装置C中应加入_________(填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________(填“上”或“下”)层。
(6)若产物中有少量未反应的Br2,最好用________(填字母代号)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用__________的方法除去。
(8)判断该制备反应已经结束的最简单方法是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. 2-甲基丁烷也称异丁烷
B. 由乙烯生成乙醇属于加成反应
C. C4H9Cl有3种同分异构体
D. 汽油、柴油、润滑油和植物油的主要成分都是碳氢化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的单质及其作合物用途非常广泛。回答下列问题:
(1)某热电池放电时总反应为4Li+FeS2==Fe+2Li2S。该电池的正、负极材料分别是_______、____。
(2)Na2FeO4是一种优良的水处理剂。
①Na2FeO4可将水体中NH3转化为N2而除去同时产生红褐色沉淀,1mol Na2FeO4最多可脱除NH3的物质的量为______________________。
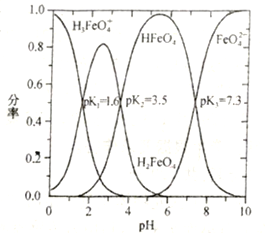
②Na2FeO4溶于水,溶液中含六价铁的微粒分率(某六价铁微粒数与所有六价铁微粒总数之比)与溶液pH关系如下图所示(已知常温下,H3FeO4+![]() H++H2FeO4,H2FeO4
H++H2FeO4,H2FeO4![]() H++HFeO4-,HFeO4-
H++HFeO4-,HFeO4-![]() H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O
H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O![]() HFeO4-+OH-的pK=______。
HFeO4-+OH-的pK=______。
(3)CO还原铁的氧化物时,涉及以下反应:
a.Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H1
3Fe(s)+4CO2(g)△H1
b.FeO(g)+CO(g) ![]() Fe(s)+CO2(g)△H2
Fe(s)+CO2(g)△H2
c.3Fe2O3(s)+CO(g) ![]() 2 Fe3O4 (s)+CO2(g)△H3
2 Fe3O4 (s)+CO2(g)△H3
d. Fe3O4 (s)+CO(g) ![]() 3FeO(s)+CO2(g)△H4
3FeO(s)+CO2(g)△H4
相关反应的温度与混合气体中CO的体积分数的关系如下图所示:
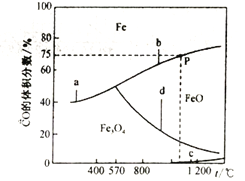
①反应的△H>0的是__________(选填a、b、c、d);△H4 =_______(用△H1、△H2表示)。
②在恒容密闭容器中,加入7.2gFeO,同时充入0.1molCO,升高温度,若恰好处于图中P点处,CO的转化率为_______,容器中生成单质Fe的质量为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A.BaCl2=Ba++2Cl-B.NaOH=Na++OH-
C.H2SO4= H22++SO42-D.KNO3=K++N5++3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组欲制取SO2,并探究SO2与FeCl3溶液的反应。在图中选用必要装置完成实验。

(1)所选装置按气流方向的连接顺序为_________(填仪器接口的字母编号)。
(2)装置A中盛放浓硫酸和铜片的仪器名称为________,发生反应的化学方程式为______。
(3)欲配制装置C中100mL1mol/LFeCl3溶液,需要用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_______;所配溶液需用盐酸酸化,请结合离子方程式解释原因: _______ 。
(4)实验过程中观察到装置C中的实验现象为溶液由棕黄色变成红棕色,最终变成浅绿色。甲同学认为红棕色的出现,可能是产生了Fe(OH)3胶体,再混合其他颜色导致;乙同学查阅资料发现Fe(HSO3)2+为红棕色,且具有较强的还原性,认为红棕色是Fe(HSO3)2+所引起。你认为____(填“甲”或“乙”)同学分析较为合理,原因为__________,验证两位同学结论的方法为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中下列做法与盐的水解有关的是
A. 用硫酸铜溶液对游泳池中的水消毒
B. 用白醋除去菜刀上的铁锈
C. 用热的苏打溶液除去餐具上的油渍
D. 用石英砂过滤器除去自来水中少量的泥沙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com