
【题目】下列关于有机化合物的说法正确的是( )
A. 2-甲基丁烷也称异丁烷
B. 由乙烯生成乙醇属于加成反应
C. C4H9Cl有3种同分异构体
D. 汽油、柴油、润滑油和植物油的主要成分都是碳氢化合物
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) =2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45 mol·L-1·s-1、②v(B)=0.6 mol·L-1·s-1、③v(C)=0.4 mol·L-1·s-1、④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④
C. ②>①=④>③ D. ①>④>②=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜可用于彩色照相,是一种白色结晶状粉末,见光分解,在空气中会慢慢氧化成绿色,溶于氢溴酸、盐酸、硝酸和氨水,在热水中也会发生分解。实验室制备CuBr的装置示意图和步骤如下:
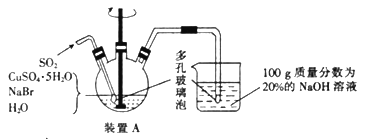
实验步骤:
①在装置A中加人50.0 g CuSO4o5H2O、30.9 g NaBr、150 mL蒸馏水,60℃时不断搅拌,以适当流速通入SO2;
②溶液冷却后倾去上层清液,在避光的条件下过滤;
③依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤;
④在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品21.6 g。
回答下列问题:
(1)步骤②中过滤需要避光的原因是________________________________________________。
(2)步骤①中实验所用蒸馏水事先要进行的处理操作是_______________,控制反应在60℃条件下进行,实验中可采取的措施是________________________。
(3)步骤③中洗涤剂需“溶有SO2”的原因是__________________________________;最后洗涤剂改用乙醚的目的是_____________________________________。
(4)装置A中反应生成CuBr的离子方程式为__________________________;说明反应已完成的现象是_____________________________________________________。
(5)本实验产品的产率是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬钙G是评价较好的解热、镇痛、消炎药,下面是它的一种合成路线(具体反应条件和部分试剂略)

已知①氯化亚砜(SOCl2)可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
② (X表示卤素原子)
(X表示卤素原子)
③R-X+NaCN![]() RCN+NaX
RCN+NaX
回答下列问题:
(1)写出D的结构简式:_______________。
(2)B→C的反应类型是___________;F中所含的官能团名称是_________。
(3)写出F和C在浓硫酸条件下反应的化学方程式_______________。
(4)A的同分异构体中符合以下条件的有______种(不考虑立体异构)
①属于苯的二取代物;②与FeCl3溶液发生显色反应。
其中核磁共振氢谱图中共有4个吸收峰的分子的结构简式为____________。
(5)结合上述推断及所学知识,参照上述合成路线任选无机试剂设计合理的方案,以苯甲醇(![]() )为原料合成苯乙酸苯甲酯(
)为原料合成苯乙酸苯甲酯(![]() )写出合成路线__________,并注明反应条件。
)写出合成路线__________,并注明反应条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。
已知:Na2S、Na2CO3、Na2SO3、NaHCO3溶液呈碱性;NaHSO3溶液呈酸性。
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填字母代号)。
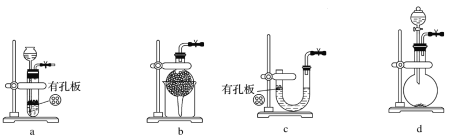
(2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为_____________________________________;
②当浅黄色沉淀不再增多时,反应体系中有无色无味的气体产生,反应的化学方程式为________________________________;
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入过量的SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为________________________。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X2+的核外电子排布式为1s22s22p6,下列说法正确的是( )
A. X可能为稀有元素 B. X原子的核外电子排布为1s22s22p63s2
C. X原子的核外电子排布为1s22s22p62d2 D. X2+的最外电子层上有6个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )
A. 该元素原子中共有25个电子
B. 该元素原子核外有4个能层
C. 该元素原子最外层共有2个电子
D. 该元素原子M电子层共有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如图所示。下列叙述错误的是
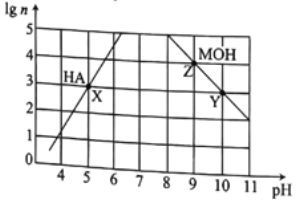
A. MOH为强碱,HA为弱酸
B. 水的电离程度:X=Y>Z
C. 若升高温度,Y、Z点对应溶液的pH值均减小
D. 将X点溶液与Z点溶液等体积混合,所得溶液中c(A-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是

A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为10-4.74 mol·L-1
C. 当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com