
【题目】日常生活中下列做法与盐的水解有关的是
A. 用硫酸铜溶液对游泳池中的水消毒
B. 用白醋除去菜刀上的铁锈
C. 用热的苏打溶液除去餐具上的油渍
D. 用石英砂过滤器除去自来水中少量的泥沙
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】某原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )
A. 该元素原子中共有25个电子
B. 该元素原子核外有4个能层
C. 该元素原子最外层共有2个电子
D. 该元素原子M电子层共有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年新学期初,市教育局在全市中小学开展了“节约用水用电,倡导绿色简约生活”的活动。下列做法不应该提倡的是
A.路远的同学可乘公交车上学B.作业不要使用修正带或涂改液
C.将化学实验室的废水直接排入水池D.养成随手关水关灯的习惯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是

A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为10-4.74 mol·L-1
C. 当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料及催化剂等方面应用广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺流程:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___________________,“浸渣”的成分除Fe2O3,FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnC12将Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnC12后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,滴定时反应的离子方程式为____________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol,当除钙率达到99%时,除钙后的溶液中c(F-)=____mol·L-1[已知Ksp(CaF2)=4.0×10-11]。
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是______________。
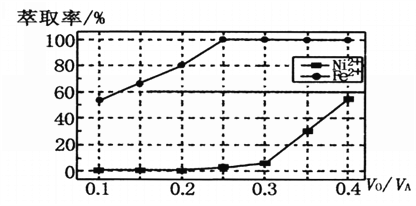
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某容积一定的密闭容器中充入2molSO2和1molO2,一定条件下发生如下反应:2SO2+O2![]() 2SO3。下列说法不正确的是
2SO3。下列说法不正确的是
A. 升高温度或充入一定量O2均能加快化学反应速率
B. 达到平衡状态时,SO2、O2、SO3物质的量之比一定为2:1:2
C. 当SO2的生成速率与SO3的生成速率相等时,反应达到平衡状态
D. 达到平衡状态时,生成SO3的物质的量一定小于2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: . X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为 .
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号) .
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式) , 原因是 .
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式: .
(5)R的一种配合物的化学式为RCl36H2O.已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O
D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为: , 继续滴加氨水至过量,沉淀溶解, 得到天蓝色溶液,写反应的离子方程式为: .
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 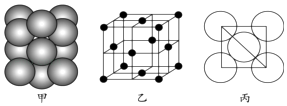
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为gcm﹣3(用字母表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学离不开实验,氨气和乙酸乙酯的制备分别是无机实验和有机实验的典型代表。请结合已有药品(选择性使用)和已学知识,回答下列问题:
(1)氨气的制备
现提供药品有:氯化铵固体、浓氨水、浓硫酸、碱石灰、水
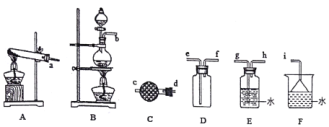
①该实验条件下,氨气的发生装置应选择上图中的_____(填大写字母)
②C的作用是_____。
③欲收集一瓶干燥的氨气,选择上图中的部分装置,其连接顺序为:发生装置→______(气流方向,用小写字母表示)。
(2)乙酸乙酯的制备
现提供药品有:乙酸、乙醇、浓硫酸、水、氢氧化钠溶液
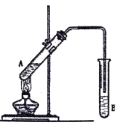
①浓硫酸在该反应中的作用是_____________
②该实验条件下,试管B内盛放的液体是____,可以判断该实验反应结束的现象为_______
③该实验制各少量的乙酸乙酯,产率往往偏低,除本身反应可逆外的原因可能还有(填一点即可):______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com