
【题目】常温下,向20.00mL0.1000molL﹣1的醋酸溶液中逐滴加入0.1000molL﹣1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( ) 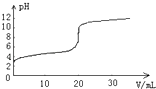
A.在反应过程中始终,c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣)
B.pH=4时,c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
C.pH=6时,c(CH3COO﹣)+c(CH3COOH)=0.1000 molL﹣1
D.pH=7时,消耗NaOH溶液的体积小于20.00mL
【答案】C
【解析】解:A.在反应过程中,一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣),故A正确;
B.pH=4的溶液呈酸性,则c(H+)>c(OH﹣),根据电荷守恒可知:c(CH3COO﹣)>c(Na+),则溶液中离子浓度的大小为:c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣),故B正确;
C.pH=6时,溶液体积大于20mL,则此时的溶液中c(CH3COO﹣)+c(CH3COOH)<0.1000 molL﹣1,故C错误;
D.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液水解呈碱性,若使溶液呈中性,则消耗NaOH溶液的体积小于20.00mL,故D正确;
故选C.
A.反应后的溶液一定满足电荷守恒,根据电荷守恒分析;
B.pH=4时,溶液呈酸性,则c(H+)>c(OH﹣),结合电荷守恒判断;
C.pH=6时,由于加入了氢氧化钠溶液,溶液体积增大,则c(CH3COO﹣)+c(CH3COOH)<0.1000 molL﹣1;
D.如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液呈碱性,若为中性,则加入的氢氧化钠溶液体积小于20.00mL.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=______mol/L( 列出计算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol.
(3)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=![]() )的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
)的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.

④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、磷及其化合物是非常重要的物质。
(1)Cu+的电子排布式____;
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个;
(3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____;
(4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____;
(5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色. 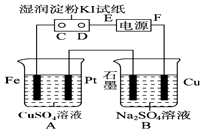
(1)E为电源的极,Fe为极.
(2)A中发生反应的离子方程式为 , B中发生反应的化学方程式为 .
(3)在B中观察到的现象是
(4)若此电源为铅蓄电池,电池总反应式为: Pb+PbO2+4H++2SO42﹣ ![]() PbSO4+2H2O
PbSO4+2H2O
则放电时:正极的电极反应式是;充电时:阴极的电极反应式是;当外电路通过1mol电子时,理论上负极板的质量增加g,此时若要使A池中的溶液复原,应加入g的CuO固体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。已知,能量密度=电池输出电能/燃料质量,以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
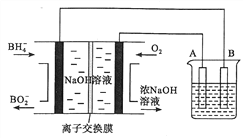
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=B![]() +6H2O
+6H2O
C. 若NaBH4 燃料电池的电压为U伏,则此电池的能量密度为2.03×104UkJ·kg-1
D. 每消耗2.24 L O2(标准状况)时,A电极的质量减轻12.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治禽流感病毒是目前人类面临的一个重大课题。八角茴香属于草本植物,是我国民间常用做烹调的香料。医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体。莽草酸的结构简式如图所示,下列关于莽草酸的说法正确的是( )
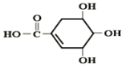
A. 莽草酸的分子式为C7H4O5
B. 莽草酸的分子之间不能发生酯化反应
C. 1mol莽草酸能与4mol Na反应
D. 莽草酸不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( ) 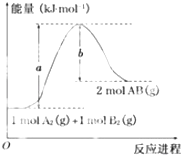
A.每生成2分子AB吸收b kJ热量
B.断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a﹣b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.Mg的摩尔质量是24g/mol
B.22gCO2物质的量为2.2mol
C.1molCl2中含有的氯原子数约为6.02×1023
D.常温常压下,1molN2的体积是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com