
【题目】下列说法中,正确的是( )
A.Mg的摩尔质量是24g/mol
B.22gCO2物质的量为2.2mol
C.1molCl2中含有的氯原子数约为6.02×1023
D.常温常压下,1molN2的体积是22.4L
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F基态原子的核外电子排布式为______________________。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是___________(用元素符号回答)。
(3)元素B的简单气态氢化物的沸点___________(填“高于”或“低于”)元素A的简单气态氢化物的沸点,其主要原因是______________________。
(4)由A、B、C形成的离子CAB与AC2互为等电子体,则CAB的结构式为___________。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为___________。

(6)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000molL﹣1的醋酸溶液中逐滴加入0.1000molL﹣1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( ) 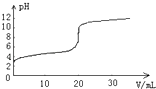
A.在反应过程中始终,c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣)
B.pH=4时,c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
C.pH=6时,c(CH3COO﹣)+c(CH3COOH)=0.1000 molL﹣1
D.pH=7时,消耗NaOH溶液的体积小于20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为有机物,其中A 常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。已知醛基在氧气中易氧化成羧基,请回答下列问题:
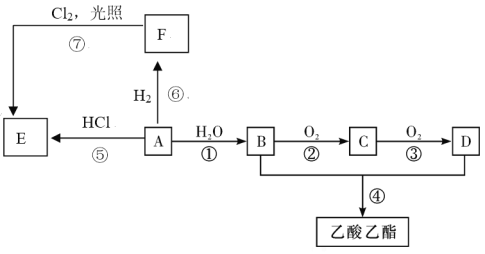
(1)A的分子式是_________,B中官能团的名称_____________。在反应①~④中,属于加成反应的是__________(填序号)。
(2)写出反应②的化学方程式:______________________________________________。
写出反应④的化学方程式:_________________________________________________。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( ) 
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e﹣=Cu
C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动
D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池的工作原理如图所示。其中多孔电极材料选用纳米多孔金时, 该电池表现出良好的循环性能。电池反应为: 2Li+O2=Li2O2。 下列说法错误
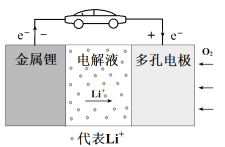
A. 该电池的电解液常用锂盐的有机溶液
B. 电池工作时,外电路中流过 0.01 mol 电子,负极材料减重 0.07g
C. 电池工作时,正极反应可能经过两个过程: Li++O2+e-=LiO2 Li++LiO2+e-=Li2O2
D. 电池充电时间越长,电池中 Li2O2越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置能完成相应实验的是( ) 
A.装置①测定化学反应速率
B.装置②制取并吸收HCl
C.装置③量取8.5mL的稀硫酸
D.装置④模拟铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吲哚昔酚 (idoxifene)可用于治疗骨质疏松症,它的合成路线如 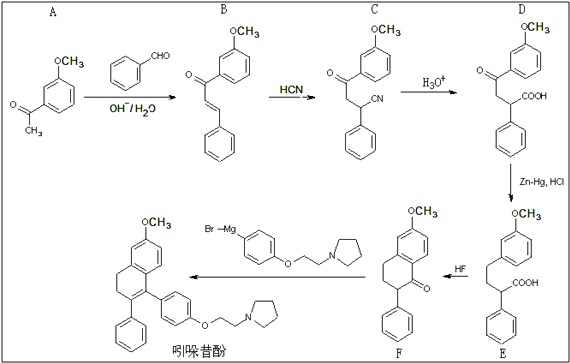
(1)反应类型:B→C;D→E
(2)D中的含氧官能团为(写名称)
(3)满足下列四个条件的A的同分异构体数目有种. ①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;③与FeCl3溶液作用不显色;④不与氢氧化钠水溶液反应
(4)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六元环,G结构简式为
(5)2,2﹣二甲基戊酸[CH3CH2CH2C(CH3)2COOH]是有机合成中间体,请设计合理的方案以丙酮(CH3COCH3)为唯一有机原料合成2,2﹣二甲基戊酸异丙酯(用合成路线流程图表示,并注明反应条件) 提示:①合成过程中无机试剂任选;②丙酮分子间能发生如图合成路线中A→B的类似反应;③合成路线流程图示例:CH3CH2OH ![]() CH2═CH2
CH2═CH2 ![]() CH2Br﹣CH2Br.
CH2Br﹣CH2Br.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气的主要污染物之一,能形成酸雨、雾霾。大气中的氮氧化物主要来源于燃料的燃烧。
(1)已知:N2(g)+O2(g)![]() 2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
(2)T℃时,向1L恒容密闭容器中充入1molN2O3和1molO2,发生反应;N2O3(g)+O2(g)![]() N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
(3)用活化后的N2O5作催化剂,氨气可将NO和O2还原成N2和H2O。若参加反应的NH3和NO的物质的量相等,则该反应的化学方程式为___________。已知该反应的平衡常数与温度的关系为lg K=5.08+![]() 。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
(4)图I是用食盐水作电解液电解烟气脱氮的一种原理图,NO 被阳极产生的氧化性物质氧化为NO3-,尾气经氢氧化钠溶液吸收后再排入空气中。电流密度和溶液pH对烟气脱氮的影响如图II。
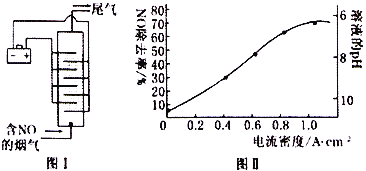
①处理后的尾气中,一定含有的气体单质是___________(填化学式)。
②溶液的pH对NO除去率有影响的原因是___________。
③若电极板面积为10cm2,实验烟气含NO的体积分数为1.5%,流速为0.070 L·s-1(气体体积已折算成标准状况,且烟气中无其他气体被氧化),测得电流密度为1.0A·cm-2。实验中NO除去率为___________(法拉第常数为96500C·mol-1))。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com