
【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | BaCO3 | MgO | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A.A
B.B
C.C
D.D
科目:高中化学 来源: 题型:
【题目】防治禽流感病毒是目前人类面临的一个重大课题。八角茴香属于草本植物,是我国民间常用做烹调的香料。医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体。莽草酸的结构简式如图所示,下列关于莽草酸的说法正确的是( )
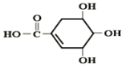
A. 莽草酸的分子式为C7H4O5
B. 莽草酸的分子之间不能发生酯化反应
C. 1mol莽草酸能与4mol Na反应
D. 莽草酸不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以硫铁矿烧渣(含Fe2O3、Fe3O4、Al2O3、CaO、SiO2等)为原料制取软磁用Fe2O3(要求纯度>99.2%,CaO含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
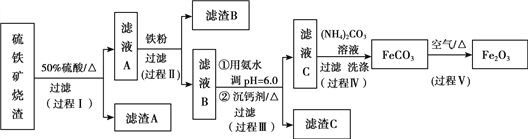
已知:生成氢氧化物的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)滤渣A的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。反应后,可以用__________溶液检验说明Fe3+是否已经完全反应。
(3)在过程Ⅱ中,课题组对滤液A稀释不同倍数后,加入等质量的过量铁粉,得出Fe3+浓度、还原率和反应时间的关系如图所示:
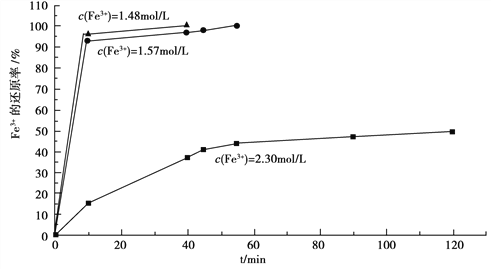
结合上述实验结果说明:课题组选择稀释后c(Fe3+)为1.60mol/L左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:
(已知:滤液B中钙的含量以CaO计为290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果,选择适宜的沉钙剂,得到滤渣C的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以铁为阳极,探究不同条件下阳极发生的电极反应。
实验装置 | 实验 | 电压 | 电解液 | 实验现象 |
| ⅰ | 3V | 3mol/LNa2SO4溶液 | 碳棒表面有大量气泡产生,溶液变黄,有红褐色沉淀产生 |
ⅱ | 3V | 3 mol/L KI溶液 | 碳棒表面有大量气泡产生,铁丝附近溶液变为棕色,逐渐变为棕褐色,约5min后,棕褐色消失,逐渐产生灰绿色絮状物 | |
ⅲ | 3V | 3mol/L NaOH溶液 | 两电极上都有大量气泡产生,5min后停止实验,取出铁丝,铁丝明显受腐,附有红棕色固体,溶液中未见沉淀物。 |
(1)①实验ⅰ中碳棒表面产生的气体是__________。
②实验ⅲ中铁丝上生成气体的电极反应式为__________。
③在实验ⅱ中,为验证铁丝电极的产物,取少量铁丝附近棕色溶液于试管中,滴加2滴K3Fe(CN)6溶液,无明显变化;另取少量铁丝附近棕色溶液检验发现溶液中有I2,检验方法是__________;对比实验ⅰ、ⅱ、ⅲ,可得出的结论是__________。
(2)为进一步探究增大c(OH-)对阳极反应的影响,该小组利用原装置做了实验ⅳ。
实验 | 电压 | 电解液 | 实验现象 |
ⅳ | 3V | 10 mol/L NaOH溶液 | 两电极上都有大量气泡产生,但碳棒上的速率远大于铁丝,且阳极区溶液逐渐变紫红色;停止实验,铁丝明显变细,电解液仍然澄清 |
查阅资料:FeO42-在溶液中呈紫红色。阳极电极反应式是__________。
(3)为探究实验ⅰ中溶液变黄的原因,该小组利用原装置做了实验ⅴ和ⅵ。
实验 | 电压 | 电解液 | 实验现象 |
ⅴ | 3V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面有大量气泡产生,铁丝外围包裹一层白色絮状沉淀,2min后表层变为褐色。 |
ⅵ | 8V | 煮沸冷却的3 mol/L Na2SO4溶液 | 碳棒表面迅速产生大量气泡,铁丝表面有气泡,1min后外围包裹一层白色絮状沉淀,2min后变绿,溶液中有红褐色悬浮物。 |
①实验ⅵ中白色絮状沉淀变为红褐色的反应化学方程式是__________。
②由此确定实验ⅰ中溶液变黄的原因是__________。
(4)综合上述实验,当铁为阳极时,影响电解过程中的阳极电极产物的因素有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1)Zn原子基态核外电子排布式为_____________________________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO42-互为等电子体的阴离子化学式为________________(写出一种)
②氨的热稳定性强于膦(PH3),原因是____________________________。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu< IZn的原因是___________________。
(4)《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。Zn、C、O电负性由大至小的顺序是_________________。ZnCO3中阴离子的立体构型是_____________________。
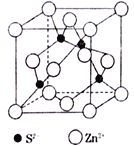
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为________________。晶胞边长为apm,阿伏加德罗常数的值为NA,则ZnS晶体的密度为 __________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A 等为原料合成蒽环酮的中间体G 的合成路线如下:
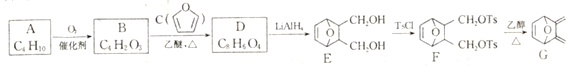
已知以下信息:
①B 中含有五元环状结构; ![]() ;
;
②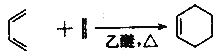 ;
;
③(CH3CO)2O或CH3COOC2H5![]() 2CH3CH2OH。
2CH3CH2OH。
回答下列问题:
(1)A的化学名称是____________________________。
(2)由B生成D和F生成G 的反应类型分别是_________________、____________________。
(3)D的结构简式为_____________________________。
(4)由E 生成F 的化学方程式为__________________________________。
(5)芳香化合物X是D 的同分异构体,X 分子中除苯环外不含其他环状结构,X 能与Na2CO3溶液反应,其核磁共振氢谱有4 组峰,峰面积之比为1:1:2 :2。写出1种符合要求的X 的结构简式:________________________________________________。
(6)写出以环戊烯(![]() ))和丙烯酸乙酯(
))和丙烯酸乙酯(![]() )为原料制备化合物
)为原料制备化合物![]() 的合成路线:_________________________________________________________(其他试剂任选)。
的合成路线:_________________________________________________________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com