
| A、Ag | B、Cu | C、Fe | D、Zn |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素. |
| B元素原子的核外p电子数比s电子数少1. |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满. |
| E元素的主族序数与周期数的差为4. |
| F是前四周期中电负性最小的元素. |
| G在周期表的第七列. |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属氧化物不一定是酸性氧化物,金属氧化物不一定为碱性氧化物 |
| B、联合制碱法在滤出NaHCO3后,为使滤液中NH4Cl析出更多更纯,通氨气加食盐冷却 |
| C、发生化学反应时失去电子数越多的金属原子,还原能力不一定越强 |
| D、氯水、Na2O2、活性炭都能使品红溶液褪色,但原理彼此都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体的种类 |
| B、气体的物质的量 |
| C、气体分子本身的大小 |
| D、气体分子之间的平均距离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池放电时,电池负极周围溶液的pH不断增大 |
| B、电池的总反应式是:Cd+2NiO(OH)+2H2O═Cd(OH)2+2Ni(OH)2 |
| C、电池充电时,镉元素被还原 |
| D、电池充电时,电池正极和电源的正极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、38.5% | B、77% |
| C、6.4% | D、97.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O |
| B、铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe2++H2↑ |
| C、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| D、硫酸铜溶液与氢氧化钡溶液混合 Cu2++2OH-═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
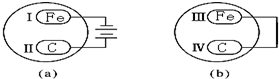
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com