
分析 (1)由H2、C2H2、C2H4组成的1L混合气体在一定条件下发生加成反应,方程式分别为2H2+C2H2→C2H6,H2+C2H4→C2H6,可利用端值法计算x的取值范围,结合方程式计算x=0.4时,原混合气体H2、C2H2、C2H4的体积比;
(2)当x=0.6且反应后混合气体密度为0.714g/L时,气体的平均相对分子质量为0.714×22.4=16,说明氢气过量,反应后的气体为氢气和乙烷,根据相对分子质量计算二者的体积之比,可计算氢气和乙烷的体积,然后利用反应前后的体积关系列方程组计算体积比.
解答 解:(1)由H2、C2H2、C2H4组成的1L混合气体在一定条件下发生加成反应,方程式分别为2H2+C2H2→C2H6,H2+C2H4→C2H6,由方程式可知,如果恰好是乙烯和氢气加成,则x=0.5,如果恰好是乙炔和氢气加成,则x=$\frac{1}{3}$,所以x的取值范围是$\frac{1}{3}$<x<$\frac{1}{2}$,
设原混合气体H2、C2H2、C2H4的体积分别为x、y、z,则根据方程式可知$\left\{\begin{array}{l}{x+y+z=1}\\{2y+z=0.4}\\{y+z=0.4}\end{array}\right.$,
所以解得x=0.6,y=0.2,z=0.2,
因此混合气体H2、C2H2、C2H4的体积比是3:1:1,
答:原混合气体H2、C2H2、C2H4的体积比是3:1:1;
(2)当x=0.6且反应后混合气体密度为0.714g/L时,气体的平均相对分子质量为0.714×22.4=16,说明氢气过量,因此反应后的气体是乙烷和氢气的混合气,则二者的体积之比是$\frac{16-2}{30-16}$=1:1,所以反应后含有0.3L氢气和0.3L乙烷,
设原混合气体H2、C2H2、C2H4的体积分别为a、b、c,
则a+b+c=1,b+c=0.3,所以a=0.7,又因为2b+c=0.7-0.3=0.4,所以c=0.1,则b=0.2,
因此原混合气体H2、C2H2、C2H4的体积比为7:2:1,
答:原混合气体H2、C2H2、C2H4的体积比是7:2:1.
点评 本题考查了混合物反应的计算,为高频考点,题目难度中等,明确掌握极值法、十字相乘法在化学计算中的应用为解答关键,试题培养了学生的分析、理解能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
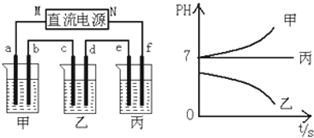
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生的气体可在空气中燃烧 |
| (C)剧烈反应,产生可燃性气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞的试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成份是氯酸钙 | B. | 氟化氢溶于水形成的氢氟酸是强酸 | ||
| C. | 碘化钾水溶液能使淀粉变蓝 | D. | 氟气通入水中有氧气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
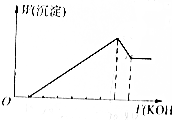 把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )| A. | 1:1 | B. | 8:9 | C. | 4:3 | D. | 4:9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com