

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
分析 铬铁矿为原料制备重铬酸钠,铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质),铬铁矿经加入纯碱、空气和辅料氧化煅烧、主反应:4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;\;△\;\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2,副反应:SiO2+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+CO2↑、Al2O3+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaAlO2+CO2↑,水浸之后除去生成的氧化铁,调节pH至4.7,除去溶液中的AlO2-、SiO32-,经酸化、蒸发结晶后后可生成重铬酸钠.
(1)固体反应物在搅拌时可充分接触而反应;
(2)氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁,副反应中生成Na2SiO3、NaAlO2等杂质;
(3)CrO42-转化为Cr2O72-,CrO42-在酸性条件下与H+离子反应生成Cr2O72-;
(4)①溶液中有碘,加入淀粉溶液呈蓝色;
②根据反应的关系式计算.
解答 解:(1)固体反应物在搅拌时可充分接触而反应,
故答案为:使反应物接触更充分,加快反应速率;
(2)氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁,副反应中生成Na2SiO3、NaAlO2等杂质,调节pH至4.7,可生成H2SiO3、Al(OH)3沉淀过滤除去,
故答案为:除去溶液中的AlO2-、SiO32-;
(3)CrO42-转化为Cr2O72-,CrO42-在酸性条件下与H+离子反应生成Cr2O72-,该反应为可逆反应,反应的离子方程式为2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(4)①溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,
故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②根据反应的关系式计算:
Cr2O72-~3I2~6S2O32-
1mol 6mol
n 0.1200mol•L-1×0.04L
n=0.0008mol,则2.5000g重铬酸钠试样中含有的重铬酸钠的质量为10×0.0008mol×262g/moL=2.096g,
所得产品的中重铬酸钠的纯度=$\frac{2.096}{2.500}$×100%=83.84%
故答案为:83.84%
点评 本题考查了物质分离提纯过程分析判断,滴定实验过程和计算应用,主要是物质性质的掌握,流程的理解应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | PVC保鲜膜属于链状聚合物,在加热时易熔化,能溶于氯仿 | |
| B. | 汽车尾气排放的NO2等气体是造成光化学污染的主要原因 | |
| C. | 点燃爆竹后,硫燃烧生成SO3 | |
| D. | 误食含有大量Cu2+的食物可以服用鲜牛奶解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
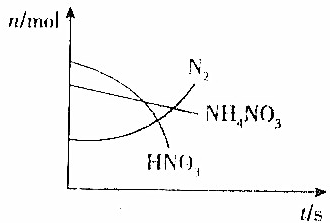 某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )
某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )| A. | N2是还原产物,Zn(NO3)2是氧化产物 | |
| B. | NH4NO3是氧化剂,Zn是还原剂 | |
| C. | 反应生成1molN2时共有5mol电子转移 | |
| D. | HNO3在反应中没有表现出酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
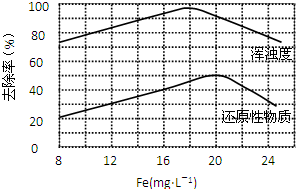 FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为合成某种液晶材料的中间体M,有人提出如下不同的合成路径:
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径: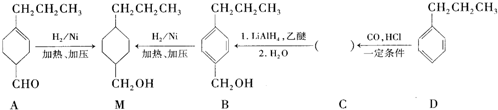
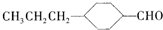 和
和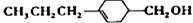 (写结构简式)生成.
(写结构简式)生成.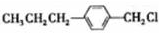 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA | |
| C. | NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA | |
| D. | 1 mol Fe在氧气中充分燃烧失去3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com